Comment les cellules réécrivent leur destin
L'étude pourrait être le point de départ de nouvelles méthodes pour modifier les mécanismes moléculaires du développement du cancer.
Une équipe internationale de chercheurs, dont Achim Leutz du Centre Max Delbrück, a découvert qu'une protéine spécifique contrôle la conversion des cellules immunitaires. S'il était possible d'intervenir dans ce processus, le développement du cancer pourrait être évité.
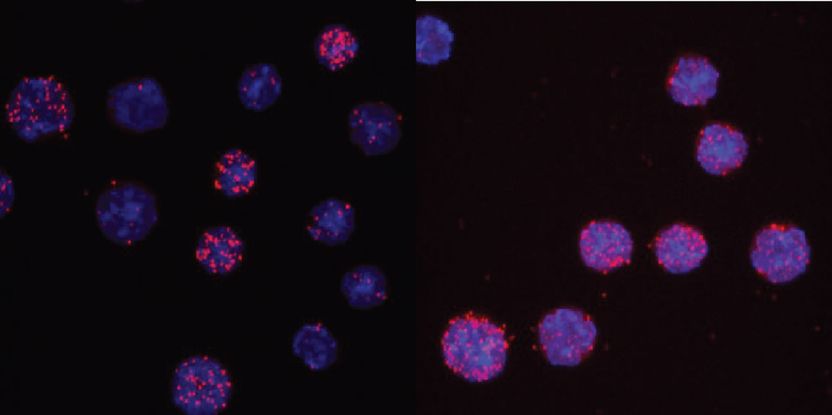
C/EBPαR35A interagit plus fortement avec PU.1 que C/EBPα non apparié. Les images montrent les noyaux des cellules en bleu clair et la lecture de l'interaction sous forme de points rouges. Pour le type sauvage, seules 3 des 13 cellules présentent des signaux, tandis que pour le mutant, 7 des 8 cellules sont positives.
Thomas Graf, Centre for Genomic Regulation
Le destin cellulaire détermine le type de cellule dans lequel une cellule se différencie et la fonction qu'elle assume dans l'organisme. Si les cellules prennent une mauvaise décision au cours de ce processus, un cancer peut se développer.
Des chercheurs du Centre de régulation génomique (CRG) de Barcelone et du Centre Max Delbrück de Berlin ont étudié comment les cellules peuvent accélérer leur destin. Ils présentent leurs résultats dans la revue scientifique "eLife". L'étude pourrait être le point de départ de nouvelles méthodes pour modifier les mécanismes moléculaires du développement du cancer.
Lâcher la bride aux phagocytes
Au cœur de l'étude se trouve la C/EBPα (CCAAT/enhancer-binding protein alpha), une protéine qui orchestre la conversion des lymphocytes B en macrophages. Les lymphocytes B sont des globules blancs qui forment des anticorps contre les agents pathogènes. Les macrophages font également partie des globules blancs. Appelés "cellules charognardes", ils trouvent et éliminent les agents pathogènes et les cellules pathologiquement altérées. C/EBPα est un facteur de transcription, un type de protéine qui se lie à des séquences d'ADN spécifiques dans les régions régulatrices des gènes où elle active ou réprime l'expression des protéines.
Comme toutes les protéines, C/EBPα est constituée de différents acides aminés. Les enzymes peuvent modifier les protéines en attachant divers groupes méthyles - qui sont de petits "autocollants" composés chacun d'un atome de carbone et de trois atomes d'hydrogène - à certains acides aminés. Ce processus est appelé méthylation. De cette manière, ils peuvent influencer fortement les interactions entre les protéines. Les chercheurs ont découvert que lorsqu'un résidu d'acide aminé spécifique de C/EBPα n'est pas méthylé, il accélère considérablement le processus de conversion des lymphocytes B en macrophages. La méthylation de ce résidu d'acide aminé spécifique est médiée par l'enzyme Carm1. Des recherches antérieures ont montré que les souris déficientes en Carm1 sont résistantes aux formes induites de leucémie myéloïde aiguë. Cela pourrait être dû aux mécanismes révélés par les chercheurs dans leur étude : la version non méthylée de C/EBPα est un inducteur plus puissant de la différenciation des macrophages que son homologue méthylé. Les macrophages étant un type de cellule qui ne se divise pas, cela pourrait empêcher la formation de cellules cancéreuses.
De nouvelles idées pour traiter la leucémie
"En comprenant comment la conversion du destin cellulaire peut être accélérée ou dirigée, nous découvrons de nouvelles pistes pour la recherche sur le cancer", explique l'auteur principal, le Dr Thomas Graf du CRG. "Par exemple, cibler l'équilibre entre les formes méthylées et non méthylées de C/EBPα peut nous aider à comprendre comment les cellules immunitaires se différencient et éventuellement conduire à de nouvelles idées pour traiter certaines formes de leucémie".
L'emplacement de l'acide aminé critique au sein de C/EBPα a été découvert lorsque les chercheurs ont testé une forme mutante de la protéine appelée C/EBPαR35A. Ce mutant accélère considérablement la vitesse à laquelle les cellules B peuvent être transformées en macrophages. Pour induire une conversion cellulaire, la protéine C/EBPα interagit avec un autre facteur de transcription appelé PU.1. Il a été constaté que le C/EBPαR35A interagissait beaucoup plus fortement avec PU.1 que le C/EBPα. Les gènes des cellules B sont ainsi réduits au silence plus rapidement et les gènes des macrophages sont activés.
Médicaments contre les cellules "confuses
La méthylation de C/EBPα est un exemple de mécanisme épigénétique. Il s'agit de mécanismes qui modifient la façon dont le génome - le manuel d'instructions à l'intérieur de chaque cellule du corps humain - est lu. "Les médicaments qui agissent sur les mécanismes épigénétiques peuvent en effet modifier la fonction des facteurs de transcription et corriger les cellules qui se sont égarées, comme c'est le cas dans le cancer et la leucémie", explique l'auteur principal, le Dr Achim Leutz, chef du groupe de recherche "Différenciation cellulaire et tumorigenèse" au Centre Max Delbrück. Dans ce nouveau mécanisme, PU.1 est déclenché par C/EBPα pour passer du statut de régulateur des cellules B à celui de régulateur des macrophages, un élégant mécanisme "marche-arrêt" qui garantit la formation fidèle d'un type de cellule mature, évitant la formation de cellules "confuses" que l'on observe souvent dans les cancers du sang. On pourrait donc trouver des médicaments qui ciblent ce mécanisme pour corriger de tels défauts.
On ignore encore beaucoup de choses sur ce qui détermine la vitesse et la directionnalité des décisions relatives au destin cellulaire. Les travaux suggèrent que les deux processus sont les deux faces d'une même pièce. Par exemple, comment les cellules souches se transforment-elles séquentiellement en différents types de cellules dans le corps ? Mieux comprendre comment les cellules changent d'identité et comment manipuler le processus pourrait avoir des applications allant de la médecine régénérative à l'amélioration de l'efficacité des médicaments contre le cancer.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.