Mélanger et assortir : Comment un méthanogène crée son propre mécanisme de réduction des sulfates
Une découverte qui ouvre des perspectives intéressantes pour la production de biocarburants
Des scientifiques de l'Institut Max Planck de microbiologie marine de Brême, en Allemagne, ont découvert les secrets moléculaires d'un microbe producteur de méthane capable de transformer le sulfate en sulfure, un élément de construction cellulaire prêt à l'emploi. Cette découverte ouvre des perspectives intéressantes pour la production de biocarburants.

Marion Jespersen, doctorante, travaille sur un fermenteur dans lequel M. thermolithotrophicus se développe exclusivement sur le sulfate comme source de soufre.
Tristan Wagner, Max-Planck-Institut für Marine Mikrobiologie
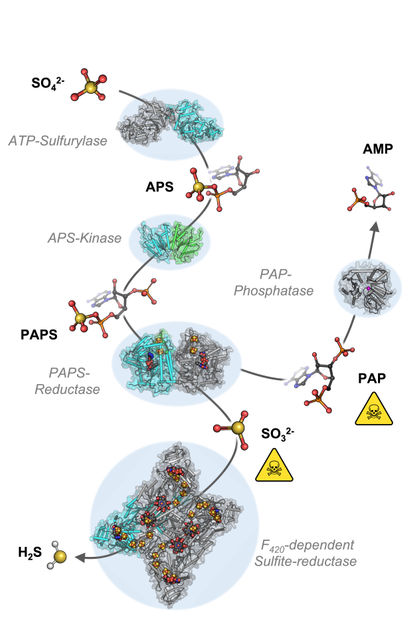
Cascade de réactions chimiques partant du sulfate (SO42-) pour aboutir au sulfure (H2S).
Marion Jespersen, Max-Planck-Institut für Marine Mikrobiologie

Le soufre, un élément essentiel de la vie
Le soufre est un élément fondamental de la vie et tous les organismes en ont besoin pour synthétiser des matériaux cellulaires. Les autotrophes, comme les plantes et les algues, acquièrent du soufre en convertissant le sulfate en sulfure, qui peut être incorporé dans la biomasse. Toutefois, ce processus nécessite beaucoup d'énergie et produit des intermédiaires et des sous-produits nocifs qui doivent être immédiatement transformés. Par conséquent, on pensait auparavant que les microbes connus sous le nom de méthanogènes, qui sont généralement à court d'énergie, seraient incapables de convertir le sulfate en sulfure. On supposait donc que ces microbes, qui produisent la moitié du méthane mondial, dépendaient d'autres formes de soufre, comme le sulfure.
Un méthanogène assimilant le sulfate ?
Ce dogme a été brisé en 1986 avec la découverte du méthanogène Methanothermococcus thermolithotrophicus, qui se développe sur le sulfate comme seule source de soufre. Comment cela est-il possible, compte tenu des coûts énergétiques et des intermédiaires toxiques ? Pourquoi est-ce le seul méthanogène qui semble être capable de se développer sur cette espèce de soufre ? Cet organisme utilise-t-il des astuces chimiques ou une stratégie encore inconnue pour permettre l'assimilation du sulfate ? Marion Jespersen et Tristan Wagner, de l'Institut Max Planck de microbiologie marine, ont trouvé les réponses à ces questions et les ont publiées dans la revue Nature Microbiology.
Le premier défi que les chercheurs ont relevé a été d'amener le microbe à se développer sur la nouvelle source de soufre. "Lorsque j'ai commencé mon doctorat, j'ai vraiment dû convaincre M. thermolithotrophicus de manger du sulfate plutôt que du sulfure", explique Marion Jespersen. "Mais après avoir optimisé le milieu, Methanothermococcus est devenu un pro de la culture sur sulfate, avec des densités cellulaires comparables à celles de la culture sur sulfure".
"Les choses sont devenues vraiment passionnantes lorsque nous avons mesuré la disparition du sulfate au fur et à mesure que l'organisme se développait. C'est à ce moment-là que nous avons pu prouver que le méthanogène convertissait ce substrat". Les chercheurs ont ainsi pu cultiver M. thermolithotrophicus en toute sécurité dans des bioréacteurs à grande échelle, car ils ne dépendaient plus du sulfure d'hydrogène, un gaz toxique et explosif, pour leur croissance. "Nous disposions ainsi d'une biomasse suffisante pour étudier cet organisme fascinant", explique M. Jespersen. Les chercheurs étaient maintenant prêts à entrer dans les détails des processus sous-jacents.
La première dissection moléculaire de la voie d'assimilation du sulfate
Pour comprendre les mécanismes moléculaires de l'assimilation du sulfate, les scientifiques ont analysé le génome de M. thermolithotrophicus. Ils ont trouvé cinq gènes susceptibles de coder pour des enzymes associées à la réduction du sulfate. "Nous avons réussi à caractériser chacune de ces enzymes et avons donc exploré la voie complète. Un véritable tour de force quand on pense à sa complexité", déclare Tristan Wagner, directeur du groupe de recherche Max Planck sur le métabolisme microbien.
En caractérisant les enzymes une à une, les scientifiques ont assemblé la première voie d'assimilation du sulfate d'un méthanogène. Si les deux premières enzymes de la voie sont bien connues et présentes dans de nombreux microbes et plantes, les enzymes suivantes sont d'un type nouveau. "Nous avons été stupéfaits de constater qu'il semble que M. thermolithotrophicus ait détourné une enzyme d'un organisme sulfato-réducteur dissimilateur et l'ait légèrement modifiée pour répondre à ses propres besoins", explique M. Jespersen. Alors que certains microbes assimilent le sulfate comme élément de construction cellulaire, d'autres l'utilisent pour obtenir de l'énergie dans un processus dissimilatoire, comme le font les humains lorsqu'ils respirent de l'oxygène. Les microbes qui effectuent une réduction dissimilatoire du sulfate utilisent un ensemble différent d'enzymes pour ce faire. Le méthanogène étudié ici a converti l'une de ces enzymes dissimilatrices en une enzyme assimilatrice. "Il s'agit d'une stratégie simple, mais très efficace, qui explique très probablement pourquoi ce méthanogène est capable de se développer sur le sulfate. Jusqu'à présent, cette enzyme particulière n'a été trouvée que chez M. thermolithotrophicus et chez aucun autre méthanogène", explique Jespersen.
Cependant, M. thermolithotrophicus doit également faire face à deux poisons générés lors de l'assimilation du sulfate. C'est à cela que servent les deux dernières enzymes de la voie : La première, semblable à une enzyme dissimilatrice, génère du sulfure à partir du sulfite. La seconde est un nouveau type de phosphatase très efficace pour hydrolyser l'autre poison, connu sous le nom de PAP.
"Il semble que M. thermolithotrophicus ait recueilli des informations génétiques de son environnement microbien qui lui ont permis de se développer sur le sulfate. En mélangeant les enzymes assimilatrices et dissimilatrices, il a créé son propre mécanisme fonctionnel de réduction du sulfate", explique M. Wagner.
De nouvelles voies pour les applications biotechnologiques
Les méthanogènes hydrogénotrophes, tels que M. thermolithotrophicus, ont la capacité étonnante de convertir le dihydrogène (H2, par exemple produit artificiellement à partir d'énergies renouvelables) et le dioxyde de carbone (CO2) en méthane (CH4). En d'autres termes, ils peuvent convertir le gaz à effet de serre CO2 en biocarburant CH4, qui peut être utilisé, par exemple, pour chauffer nos maisons. Pour ce faire, les méthanogènes sont cultivés dans de grands bioréacteurs. L'un des obstacles actuels à la culture des méthanogènes est leur besoin de sulfure d'hydrogène, un gaz hautement dangereux et explosif, comme source de soufre. Grâce à la découverte de la voie d'assimilation du sulfate chez M. thermolithotrophicus, il est possible de modifier génétiquement les méthanogènes déjà utilisés en biotechnologie pour qu'ils utilisent cette voie à la place, ce qui permettra de produire du biogaz de manière plus sûre et plus rentable.
"Une question brûlante non résolue est de savoir pourquoi M. thermolithotrophicus assimilerait le sulfate dans la nature. Pour cela, nous devrons aller sur le terrain et voir si les enzymes nécessaires à cette voie sont également exprimées dans l'environnement naturel du microbe", conclut M. Wagner.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.


























































