Des microbes alimentés par l'électricité
Comment les bactéries utilisent l'électricité et le dioxyde de carbone pour produire des produits chimiques utiles
Dans l'électrosynthèse microbienne, les micro-organismes utilisent leCO2 et l'électricité pour produire de l'alcool, par exemple. Cependant, le fonctionnement biologique de ce processus n'avait jusqu'à présent fait l'objet que de spéculations. Des chercheurs de l'Institut Leibniz pour la recherche sur les produits naturels et la biologie des infections (Leibniz-HKI) ont pu confirmer expérimentalement pour la première fois que les bactéries utilisent les électrons de l'hydrogène et peuvent produire plus de substances chimiques que ce que l'on connaissait jusqu'à présent.

ans de petits bioréacteurs, les chercheurs peuvent contrôler avec précision les conditions de l'électrosynthèse microbienne.
Ronja Münch/Leibniz-HKI
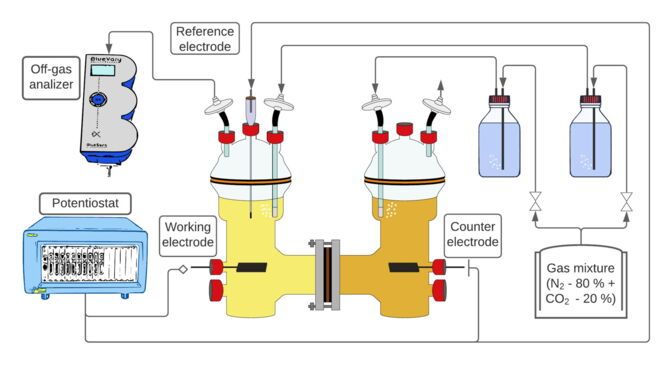
Représentation schématique du dispositif expérimental : La culture bactérienne se développe dans l'un des conteneurs, l'électricité et le CO2 sont fournis. Un deuxième récipient est utilisé pour la contre-réaction électrochimique ; de l'oxygène y est produit.
Santiago Boto/Leibniz-HKI

L'électrosynthèse microbienne est une technologie prometteuse dans le contexte du changement climatique et de la transition énergétique : elle permet de lier le dioxyde de carbone, de produire de l'éthanol et d'autres composés organiques utilisables comme carburant, et donc de stocker l'électricité excédentaire. Néanmoins, cette technologie, connue depuis plus d'une décennie, n'a pas encore réussi à faire une percée significative vers la commercialisation.
Selon Miriam Rosenbaum, directrice de l'usine pilote biologique de Leibniz-HKI, cela est principalement dû au fait que "la biologie qui sous-tend le processus a jusqu'à présent été considérée comme une sorte de boîte noire". La biochimiste, titulaire de la chaire de biotechnologie synthétique à l'université Friedrich Schiller d'Iéna, s'intéresse depuis longtemps à la question de savoir ce qui se passe exactement pendant l'électrosynthèse microbienne (MES).
Son équipe vient de faire une percée dans ce domaine précis : Les chercheurs ont pu montrer que les bactéries n'absorbent pas directement les électrons fournis par le courant électrique, mais qu'elles utilisent l'hydrogène pour transférer les électrons. On soupçonnait depuis longtemps cette possibilité, mais jusqu'à présent, personne n'en avait apporté la preuve expérimentale. Ils ont également constaté que la méthode pouvait produire des produits chimiques encore plus utiles qu'on ne le pensait et ont optimisé le processus pour obtenir les rendements les plus élevés possibles.
Des conditions contrôlées
Dans le procédé MES, de l'électricité est appliquée à une solution nutritive aqueuse contenant des micro-organismes, et du dioxyde de carbone est ajouté en même temps. Les micro-organismes utilisent l'électricité et le carbone pour produire des composés organiques tels que l'éthanol ou l'acétate. Pour ce faire, ils utilisent les électrons fournis, mais la manière dont ils le font n'était pas claire jusqu'à présent.
"Une étude supposait que les microbes utilisaient directement les électrons", explique Rosenbaum. Cette hypothèse n'a toutefois pas été prouvée. Rosenbaum pense qu'il est plus probable que les microbes utilisent l'hydrogène pour leur biosynthèse. En effet, lorsque de l'électricité et du dioxyde de carbone sont appliqués, il se produit la même chose que lors d'une électrolyse classique : L'eau se divise en hydrogène et en oxygène.
"Jusqu'à présent, personne n'avait vraiment mesuré l'hydrogène directement dans le système", explique Santiago Boto, auteur principal de l'étude. Il a donc conçu le réacteur MES de manière à pouvoir contrôler précisément tous les paramètres. Pour ce faire, il utilise une culture pure de la bactérie Clostridium ljungdahlii à différentes concentrations. En outre, il peut contrôler le flux de courant électrique et mesurer l'hydrogène produit à l'électrode et l'hydrogène s'échappant du liquide à l'aide de microcapteurs.
"Grâce à notre conception, nous avons pu rassembler plusieurs preuves que les bactéries utilisaient de l'hydrogène", a déclaré M. Boto. Lorsque la concentration de bactéries dans le milieu nutritif était telle qu'elles formaient un biofilm sur la cathode et qu'une faible quantité d'hydrogène était mesurable dans l'environnement de l'électrode, l'activité des bactéries était considérablement réduite. Ce phénomène s'est également produit lorsque la tension n'était pas suffisamment élevée pour permettre l'électrolyse. Ce n'est que lorsque les bactéries planctoniques - c'est-à-dire nageant librement - avaient accès à l'hydrogène de l'électrode qu'elles montraient une activité élevée.
Découverte de nouvelles voies de biosynthèse
L'équipe de recherche a ainsi pu optimiser la tension et la concentration bactérienne pour obtenir les rendements en acétate les plus élevés possibles. "Nous avons obtenu les valeurs d'acétate les plus élevées à ce jour pour une culture pure de bactéries", a déclaré M. Boto. Il a également constaté la formation de composés aminés que les bactéries ne produisent pas normalement. En collaboration avec Falk Harnisch du Centre de recherche environnementale de Leipzig, les travaux ont également montré que des réactions entre le milieu nutritif et la cathode, qui n'avaient pas été décrites auparavant, se produisent, accélérant apparemment le processus de synthèse.
L'équipe souhaite à présent optimiser davantage les processus et explorer spécifiquement les résultats précédents. "Les composés aminés sont très intéressants pour l'industrie chimique, et les bactéries que nous avons utilisées sont déjà utilisées dans l'industrie. Il se peut donc que nous ayons découvert une nouvelle méthode de production pour ces produits chimiques", a déclaré M. Boto. Dans l'ensemble, les résultats devraient contribuer à rendre le SEM commercialement viable. "Je m'attends à ce que cette technologie connaisse un fort essor dans les années à venir, lorsque nous aurons enfin mis l'accent sur la biologie", a déclaré M. Rosenbaum. Le Bio Pilot Plant collabore à ce projet et s'associe à des ingénieurs en procédés pour développer des réacteurs plus grands pour les MES.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.