Une nouvelle avancée dans la microscopie à fluorescence à super-résolution
Rapide même au niveau du nanomètre
Des scientifiques dirigés par Stefan Hell, lauréat du prix Nobel, à l'Institut Max Planck pour la recherche médicale de Heidelberg, ont mis au point un microscope à super-résolution d'une précision spatio-temporelle d'un nanomètre par milliseconde. Une version améliorée de leur microscopie à super-résolution MINFLUX, récemment introduite, a permis d'observer de minuscules mouvements de protéines uniques à un niveau de détail sans précédent : le mouvement de marche de la protéine motrice kinésine-1 qui se déplace le long des microtubules tout en consommant de l'ATP. Ces travaux mettent en évidence la puissance de MINFLUX en tant que nouvel outil révolutionnaire pour l'observation des changements de conformation des protéines à l'échelle du nanomètre. Ces travaux ont été publiés récemment dans la revue Science.
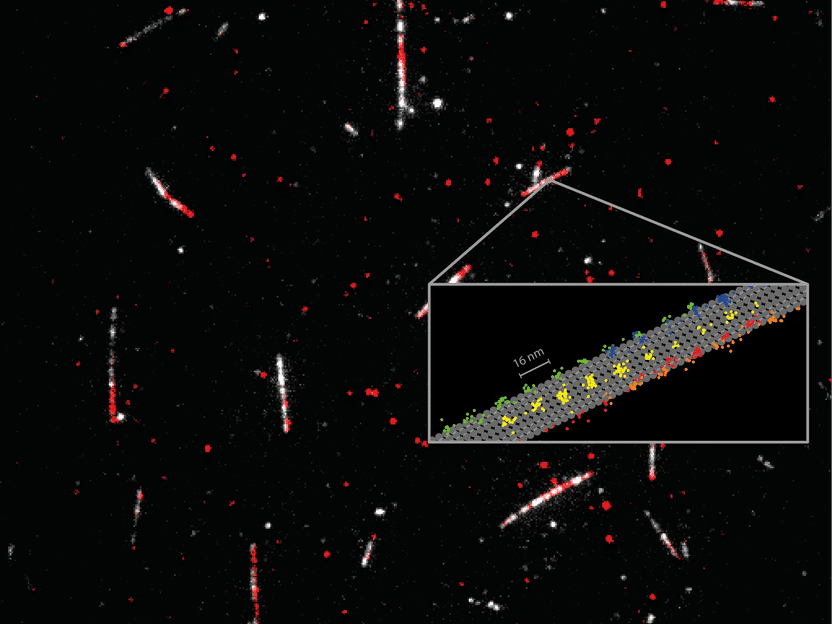
Mesure détaillée de la façon dont la protéine motrice kinésine-1 (rouge) se déplace sur les microtubules (blanc). Le suivi des mouvements 2D de dimères individuels de kinésine-1 (codés en couleur sur le croquis) à des concentrations physiologiques d'ATP a révélé des détails clés sur la façon dont la protéine se déplace dans des voies individuelles. MINFLUX a facilité le suivi du protofilament de la protéine motrice sur le microtubule (esquissé en gris) et souligne l'efficacité de MINFLUX en tant qu'outil de suivi des changements de conformation des protéines.
MPI for Medical Research
Pour comprendre le fonctionnement interne d'une cellule, il faut connaître la biochimie des protéines individuelles. La mesure d'infimes changements dans leur position et leur forme est le principal défi à relever dans ce domaine. La microscopie à fluorescence, en particulier la microscopie à super-résolution (c'est-à-dire la nanoscopie), est devenue indispensable dans ce domaine émergent. MINFLUX, le système de nanoscopie à fluorescence récemment introduit, a déjà atteint une résolution spatiale de un à quelques nanomètres : la taille de petites molécules organiques. Mais pour passer à la vitesse supérieure dans la compréhension de la physiologie cellulaire moléculaire, il est nécessaire d'effectuer des observations à une résolution spatio-temporelle encore plus élevée.
Pousser la puissance de MINFLUX
Lorsque le groupe de Stefan Hell a présenté MINFLUX pour la première fois en 2016, il avait été utilisé pour suivre les protéines marquées par fluorescence dans les cellules. Cependant, ces mouvements étaient aléatoires et le suivi avait des précisions de l'ordre de quelques dizaines de nanomètres. Leur étude publiée cette semaine dans Science est la première à appliquer le pouvoir de résolution de MINFLUX aux changements de conformation des protéines, notamment la protéine motrice kinésine-1. Pour ce faire, les chercheurs du MPI pour la recherche médicale ont développé une nouvelle version de MINFLUX pour le suivi de molécules fluorescentes uniques.
Toutes les méthodes établies pour mesurer la dynamique des protéines présentent de sérieuses limitations, ce qui les empêche de s'intéresser à la plage (sub)nanométrique / (sub)milliseconde, qui est d'une importance cruciale. Certaines méthodes offrent une résolution spatiale élevée, de l'ordre de quelques nanomètres, mais ne permettent pas de suivre les changements suffisamment rapidement. D'autres ont une résolution temporelle élevée mais nécessitent un marquage avec des billes qui sont 2 à 3 ordres de grandeur plus grandes que la protéine étudiée. Étant donné que le fonctionnement de la protéine est susceptible d'être compromis par une bille de cette taille, les études utilisant des billes laissent des questions en suspens. MINFLUX, en revanche, ne nécessite qu'une molécule fluorescente standard de 1 nm comme étiquette attachée à la protéine, et peut donc fournir à la fois la résolution et l'invasivité minimale nécessaires à l'étude de la dynamique des protéines natives. "L'un des défis consiste à construire un microscope MINFLUX qui fonctionne près de la limite théorique et qui soit protégé contre le bruit ambiant", explique Otto Wolff, doctorant au sein du groupe. "Concevoir des sondes qui n'affectent pas la fonction de la protéine, mais qui révèlent néanmoins le mécanisme biologique, en est un autre", ajoute son collègue Lukas Scheiderer.
Le microscope MINFLUX que les chercheurs présentent aujourd'hui peut enregistrer les mouvements des protéines avec une précision spatio-temporelle allant jusqu'à 1,7 nanomètre par milliseconde. Il ne nécessite la détection que d'une vingtaine de photons émis par la molécule fluorescente.
"Je pense que nous ouvrons un nouveau chapitre dans l'étude de la dynamique des protéines individuelles et de la manière dont elles changent de forme au cours de leur fonctionnement", déclare Stefan Hell. "La combinaison de la haute résolution spatiale et temporelle fournie par MINFLUX permettra aux chercheurs d'étudier les biomolécules comme jamais auparavant.
Résolution du mouvement de pas de la kinésine-1 avec l'ATP dans des conditions physiologiques
La kinésine-1 joue un rôle clé dans le transport de marchandises à travers nos cellules, et les mutations de la protéine sont au cœur de plusieurs maladies. La kinésine-1 "marche" le long des filaments (les microtubules) qui traversent nos cellules comme un réseau de rues. On peut imaginer le mouvement comme un "pas" littéral, puisque la protéine possède deux "têtes" qui changent alternativement d'emplacement sur le microtubule. Ce mouvement se produit généralement le long de l'un des 13 protofilaments formant le microtubule et est alimenté par la division de l'ATP (adénosine triphosphate), principal fournisseur d'énergie de la cellule.
En utilisant un seul fluorophore pour marquer la kinésine-1, les scientifiques ont enregistré les pas réguliers de 16 nm de chaque tête, ainsi que des sous-pas de 8 nm, avec une résolution spatio-temporelle de l'ordre du nanomètre/milliseconde. Leurs résultats ont prouvé que l'ATP est absorbé lorsqu'une seule tête est liée au microtubule, mais que l'hydrolyse de l'ATP se produit lorsque les deux têtes sont liées. Ils ont également révélé que l'enjambement implique une rotation du "pédoncule" protéique, la partie de la molécule de kinésine qui retient la cargaison. La résolution spatio-temporelle de MINFLUX a également révélé une rotation de la tête dans la phase initiale de chaque étape. Il est important de noter que ces résultats ont été obtenus en utilisant des concentrations physiologiques d'ATP, ce qui n'était pas possible jusqu'à présent avec de minuscules marqueurs de fluorescence.
Un potentiel futur dans l'exploration de la dynamique des protéines
"Je suis impatient de voir où MINFLUX va nous mener. Il ajoute une nouvelle dimension à l'étude du fonctionnement des protéines. Cela peut nous aider à comprendre les mécanismes à l'origine de nombreuses maladies et, en fin de compte, contribuer au développement de thérapies", ajoute Jessica Matthias, une scientifique postdoctorale qui travaillait auparavant dans le groupe de Hell et qui explore maintenant les applications de MINFLUX à une variété de questions biologiques.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.