Les miniprotéines sont apparues "de nulle part".
"Les résultats ouvrent de nombreuses nouvelles possibilités de recherche"
Les miniprotéines, jeunes dans l'évolution, sont uniques chez l'homme, et les chercheurs en ont récemment découvert des milliers. Dans la revue Molecular Cell, Norbert Hübner et ses collègues du BIH et d'autres institutions décrivent les origines de ces miniprotéines et expliquent qu'elles influencent probablement des processus cellulaires importants.
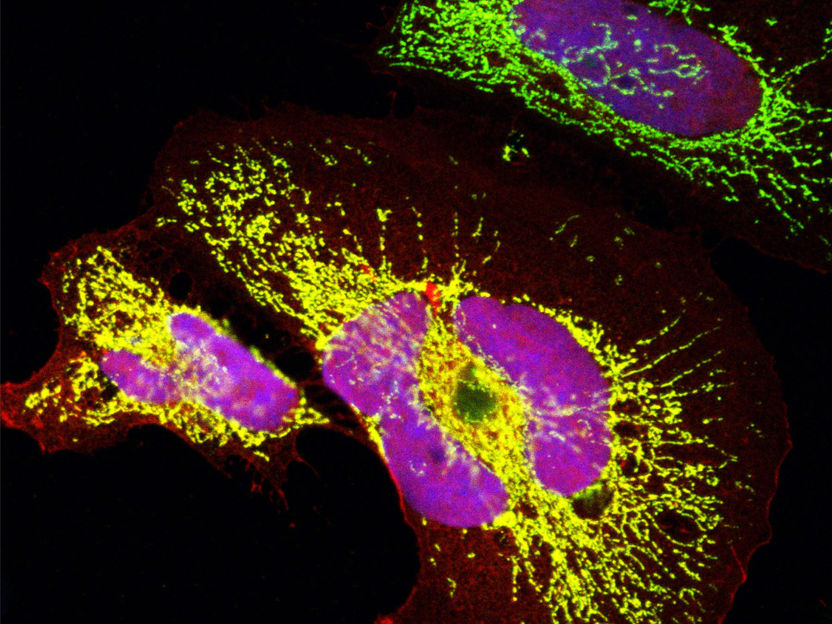
Une protéine jeune du point de vue de l'évolution qui est apparue de novo chez les singes de l'Ancien Monde : La microprotéine dans la mitochondrie (vert) et dans le noyau (bleu) a été surexprimée dans des cellules humaines. Les zones jaunes et roses montrent que le signal de la microprotéine chevauche les signaux mitochondriaux et nucléaires.
Clara Sandmann, Max Delbrück Center
Tous les biologistes savent que de petites structures peuvent parfois avoir un impact important : Des millions de molécules de signalisation, d'hormones et d'autres biomolécules s'agitent dans nos cellules et nos tissus, jouant un rôle de premier plan dans de nombreux processus clés de notre organisme. Pourtant, en dépit de ces connaissances, les biologistes et les médecins ont longtemps ignoré une catégorie particulière de protéines, partant du principe qu'en raison de leur petite taille et de leur présence uniquement chez les primates, elles étaient insignifiantes et sans fonction. Les découvertes du professeur Norbert Hübner, du centre Max Delbrück, et du docteur Sebastiaan van Heesch, du centre d'oncologie pédiatrique Princesse Máxima, aux Pays-Bas, ont changé cette opinion il y a quelques années : "Nous avons été les premiers à prouver l'existence de milliers de nouvelles microprotéines dans les organes humains", déclare Hübner.
Dans un nouvel article publié dans Molecular Cell, l'équipe dirigée par Hübner et van Heesch décrit maintenant comment elle a étudié systématiquement ces miniprotéines, et ce qu'elle en a tiré : "Nous avons pu montrer dans quelles séquences du génome les protéines sont codées et à quel moment des mutations de l'ADN ont eu lieu au cours de leur évolution", explique le Dr Jorge Ruiz-Orera, biologiste de l'évolution dans le laboratoire de Hübner et l'un des trois auteurs principaux de l'article, qui travaillent au Centre Max Delbrück et au Centre allemand de recherche cardiovasculaire (DZHK).
Les analyses génétiques bioinformatiques de Ruiz-Orera ont révélé que la plupart des microprotéines humaines se sont développées des millions d'années plus tard dans le processus d'évolution que les protéines plus grandes actuellement connues des scientifiques.
Pourtant, cet énorme écart d'âge ne semble pas empêcher les protéines de "se parler" entre elles. "Nos expériences en laboratoire ont montré que les protéines jeunes et anciennes peuvent se lier entre elles et, ce faisant, s'influencer mutuellement", explique l'auteur principal, le Dr Jana Schulz, chercheuse dans l'équipe de Hübner et au DZHK. Elle soupçonne donc que, contrairement à ce que l'on pensait depuis longtemps, les microprotéines jouent un rôle clé dans une variété de fonctions cellulaires. Les jeunes protéines pourraient également être fortement impliquées dans le développement de l'évolution grâce à des "innovations et adaptations" relativement rapides. "Il est possible que l'évolution soit plus dynamique qu'on ne le pensait jusqu'à présent", déclare M. van Heesch.
Des protéines uniquement présentes chez l'homme
Les chercheurs ont été surpris de constater que les microprotéines beaucoup plus jeunes pouvaient interagir avec la génération beaucoup plus ancienne. Cette observation est issue d'expériences réalisées à l'aide d'une méthode de criblage biotechnique développée au Centre Max Delbrück en 2017. En collaboration avec le Dr Philipp Mertins et la Plateforme de protéomique, que le Centre Max Delbrück exploite conjointement avec l'Institut de santé de Berlin à la Charité (BIH), les miniprotéines ont été synthétisées sur une membrane, puis incubées avec une solution contenant la plupart des protéines connues pour exister dans une cellule humaine. Des analyses expérimentales et informatiques sophistiquées ont ensuite permis aux chercheurs d'identifier les paires de liaison individuelles. "Si une microprotéine se lie à une autre protéine, cela ne signifie pas nécessairement qu'elle va influencer le fonctionnement de l'autre protéine ou les processus dans lesquels la protéine est impliquée", explique M. Schulz. Cependant, la capacité de se lier suggère que les protéines peuvent influencer le fonctionnement de l'autre. Les premières expériences cellulaires menées au Centre Max-Delbrück en collaboration avec les professeurs Michael Gotthardt et Thomas Willnow confirment cette hypothèse. Cela amène Ruiz-Orera à soupçonner que les microprotéines "pourraient influencer des processus cellulaires qui ont des millions d'années d'ancienneté, car certaines protéines anciennes étaient présentes dans les toutes premières formes de vie".
Contrairement aux anciennes protéines connues qui sont codées dans notre génome, la plupart des microprotéines sont apparues plus ou moins "de nulle part - en d'autres termes, à partir de régions de l'ADN qui n'étaient pas auparavant chargées de produire des protéines", explique Ruiz-Orera. Les microprotéines n'ont donc pas emprunté la voie "classique" et beaucoup plus facile qui consiste à être copiées et dérivées de versions existantes. Et comme ces petites protéines ne sont apparues qu'au cours de l'évolution humaine, elles sont absentes des cellules de la plupart des autres animaux, comme les souris, les poissons et les oiseaux. On a toutefois découvert que ces animaux possédaient leur propre collection de jeunes petites protéines.
Les plus petites protéines à ce jour
Au cours de leurs travaux, les chercheurs ont également découvert les plus petites protéines humaines identifiées à ce jour : "Nous avons trouvé plus de 200 protéines super petites, toutes d'une taille inférieure à 16 acides aminés", explique le Dr Clara Sandmann, troisième auteur principal de l'étude. Les acides aminés sont les seuls éléments constitutifs des protéines. Selon le Dr Sandmann, cela soulève la question de la taille maximale d'une protéine, ou plutôt de sa taille minimale pour qu'elle puisse fonctionner. En général, les protéines sont constituées de plusieurs centaines d'acides aminés.
Les petites protéines déjà connues des scientifiques sont appelées peptides et fonctionnent comme des hormones ou des molécules de signalisation. Elles sont formées lorsqu'elles se séparent de protéines précurseurs plus grandes. "Nos travaux montrent maintenant que des peptides de taille similaire peuvent se développer d'une manière différente", déclare Sandmann.
Ces petites protéines peuvent également se lier de manière très spécifique à des protéines plus grandes, mais on ne sait pas encore si elles peuvent devenir des hormones ou des substances similaires : "Nous ne savons pas encore ce que la plupart de ces microprotéines font dans notre corps", déclare Sandmann.
Pourtant, l'étude donne une idée de ce dont ces molécules sont capables : "Ces premiers résultats ouvrent de nombreuses nouvelles perspectives de recherche", déclare M. van Heesch. Il est clair que les microprotéines sont beaucoup trop importantes pour que les chercheurs continuent à les ignorer. Selon M. van Heesch, les communautés de recherche biomoléculaire et médicale sont très enthousiastes face à ces nouvelles découvertes. Un scénario envisageable serait "que ces microprotéines soient impliquées dans les maladies cardiovasculaires et le cancer, et qu'elles puissent donc être utilisées comme de nouvelles cibles pour les diagnostics et les thérapies", explique M. Hübner. Plusieurs sociétés de biotechnologie américaines effectuent déjà des recherches dans ce sens. L'équipe à l'origine de l'article actuel a également de grands projets : Leur étude a porté sur 281 microprotéines, mais l'objectif est maintenant d'étendre les expériences à un plus grand nombre de microprotéines parmi les 7 000 répertoriées récemment, dans l'espoir de découvrir de nombreuses fonctions encore inconnues.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
























































