Des gouttelettes de protéines pourraient être à l'origine de nombreux types de maladies génétiques
Le dysfonctionnement des condensats cellulaires est un mécanisme pathologique lié aux malformations congénitales, aux maladies courantes et au cancer.
La plupart des protéines se localisent dans des gouttelettes distinctes riches en protéines dans les cellules, également appelées "condensats cellulaires". Ces protéines contiennent des caractéristiques de séquence qui fonctionnent comme des étiquettes d'adresse, indiquant à la protéine dans quel condensat elle doit se déplacer. Lorsque ces étiquettes sont malencontreuses, les protéines peuvent se retrouver dans le mauvais condensat. Selon une équipe internationale de chercheurs en médecine clinique et en biologie fondamentale, cela pourrait être la cause de nombreuses maladies non résolues. Les résultats ont été publiés dans la revue Nature.
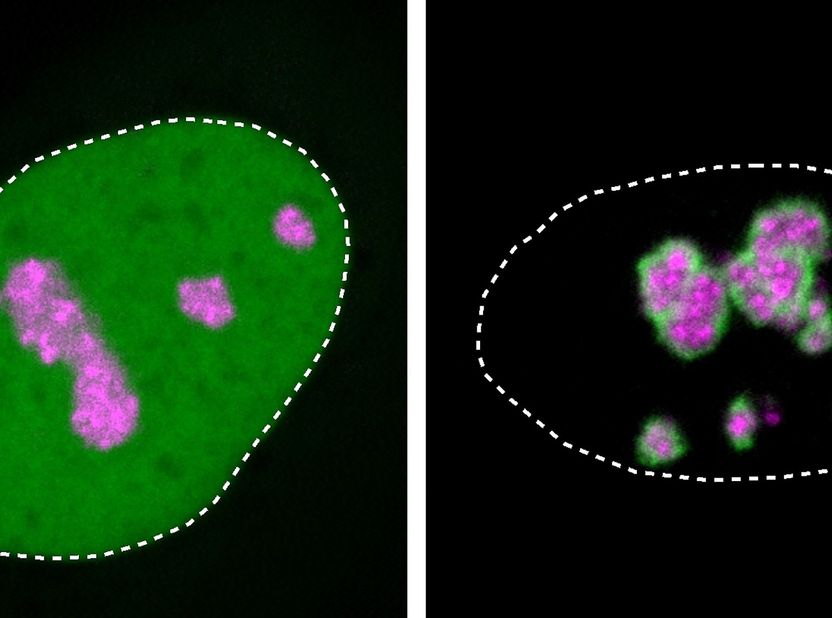
Gros plans de noyaux de cellules dans une culture de cellules humaines : La protéine HMGB1 (verte) est généralement présente dans tout le noyau (ligne pointillée). La protéine HMGB1 mutante, représentée à droite, se localise préférentiellement au nucléole (marqué en magenta) et forme une couche solidifiée au-dessus de celui-ci, ce qui provoque la maladie.
Henri Niskanen, MPIMG
Les patients atteints du syndrome BPTA présentent des membres malformés caractéristiques, avec des doigts courts et des orteils supplémentaires, des tibias manquants dans les jambes et un cerveau de taille réduite. Comme l'ont découvert les chercheurs, le BPTAS est dû à une modification génétique particulière qui entraîne la migration d'une protéine essentielle vers le nucléole, une grande gouttelette protéique située dans le noyau cellulaire. En conséquence, la fonction du condensat nucléolaire est inhibée et la maladie se développe.
"Ce que nous avons découvert dans cette maladie pourrait s'appliquer à de nombreux autres troubles. Il ne s'agit probablement pas d'une licorne rare qui n'existe qu'une fois. Jusqu'à présent, nous ne pouvions pas voir le phénomène parce que nous ne savions pas comment le rechercher", explique Denise Horn, généticienne clinique à l'Institut de génétique médicale et humaine de la Charité - Universitätsmedizin Berlin.
En collaboration avec des scientifiques de l'Institut Max Planck de génétique moléculaire (MPIMG) de Berlin, de l'hôpital universitaire du Schleswig-Holstein (UKSH) et de collaborateurs du monde entier, l'équipe ouvre la voie à de nouveaux diagnostics qui pourraient conduire à l'élucidation de nombreuses autres maladies ainsi qu'à d'éventuelles thérapies futures.
"Nous avons découvert un nouveau mécanisme qui pourrait être en jeu dans un large éventail de maladies, y compris les maladies héréditaires et le cancer", explique Denes Hnisz, chef de groupe de recherche au MPIMG. "En fait, nous avons découvert plus de 600 mutations similaires, dont 101 sont connues pour être associées à différents troubles."
"Le travail réel ne fait que commencer maintenant", ajoute Malte Spielmann, généticien humain de l'UKSH à Lübeck et Kiel. "Nous allons trouver beaucoup plus de gènes présentant de telles mutations pathologiques et nous pouvons maintenant tester leur mode d'action."
Une mutation inhabituelle
Les personnes atteintes présentent des malformations complexes et frappantes des membres, du visage et des systèmes nerveux et osseux, qui ne sont que partiellement décrites par le nom de la maladie, déjà long, "syndrome de brachyphalangie-polydactyl-aplasie/hypoplasie" (BPTAS).
"Avec moins de dix cas documentés dans le monde, la maladie est non seulement rare, mais ultra-rare", explique Martin Mensah, généticien clinique à l'Institut de génétique médicale et humaine de la Charité. Pour en trouver la cause, lui et ses collègues ont décodé le génome de cinq personnes atteintes et ont découvert que le gène de la protéine HMGB1 était altéré chez tous les patients.
Cette protéine a pour tâche d'organiser le matériel génétique dans le noyau de la cellule et facilite l'interaction d'autres molécules avec l'ADN, par exemple pour lire les gènes.
Chez la souris, une perte complète du gène sur les deux chromosomes est catastrophique et entraîne la mort de l'embryon. Chez certains patients dont une seule copie est mutée, cependant, les cellules utilisent la copie intacte sur l'autre chromosome, ce qui n'entraîne qu'un léger retard de développement neurologique. Mais les cas récemment découverts ne correspondaient pas à ce schéma.
"Les cinq personnes non apparentées présentaient toutes le même trouble ultra-rare et avaient pratiquement la même mutation", explique M. Mensah, qui est membre du programme Clinician Scientist géré par l'Institut de santé de Berlin à la Charité (BIH) et la Charité. "C'est pourquoi nous sommes sûrs que la mutation HMGB1 est à l'origine de la maladie. Cependant, à ce moment-là, nous n'avions aucune idée de la manière dont le produit du gène causait la maladie sur le plan fonctionnel, d'autant plus que les mutations de perte de fonction étaient signalées comme entraînant d'autres phénotypes."
Des extensions de protéines chargées
Un examen plus approfondi a révélé que différentes mutations de HMGB1 ont des conséquences différentes. Les données de séquençage ont montré que chez les individus affectés présentant les malformations sévères, le cadre de lecture du dernier tiers du gène HMGB1 est décalé.
Après la traduction en protéine, la région correspondante n'est plus équipée de blocs d'acides aminés chargés négativement mais positivement. Cela peut se produire s'il manque un nombre de lettres génétiques non divisible par trois dans la séquence, car trois lettres consécutives exactement codent toujours pour un élément constitutif de la protéine.
Cependant, la partie arrière de la protéine n'a pas de structure définie. Au contraire, cette partie pend de la molécule comme un élastique lâche. Les fonctions de ces queues de protéines (également appelées "régions intrinsèquement désordonnées") sont difficiles à étudier car elles ne deviennent souvent efficaces qu'en conjonction avec d'autres molécules. Alors comment leur mutation peut-elle conduire à la maladie observée ?
Gouttelettes de protéines dans la cellule
Pour répondre à cette question, les chercheurs médicaux se sont adressés aux biochimistes Denes Hnisz et Henri Niskanen du MPIMG, qui travaillent avec des condensats cellulaires contrôlant des gènes importants. Ces structures ressemblant à des gouttelettes se comportent un peu comme les gouttelettes d'huile et de vinaigre dans une vinaigrette. Composées d'un grand nombre de molécules différentes, elles sont séparées de leur environnement et peuvent subir des changements dynamiques.
"Nous pensons que les condensats se forment dans la cellule pour des raisons pratiques", explique M. Niskanen. Les molécules destinées à une tâche spécifique sont regroupées de cette manière, par exemple pour lire un gène. Pour cette seule tâche, explique-t-il, plusieurs centaines de protéines doivent se frayer un chemin jusqu'au bon endroit.
"On pense que les régions intrinsèquement désordonnées, qui n'ont généralement pas de rôle biochimique évident, sont responsables de la formation des condensats", explique M. Niskanen, en donnant un exemple pour décrire l'importance des propriétés physiques des extensions de protéines à cet égard. "Je peux facilement fabriquer une boule à partir de plusieurs élastiques lâches qui tiennent ensemble de manière relativement serrée et qui peuvent être démontés sans trop d'effort. Une boule de fil de pêche lisse ou de ruban adhésif, en revanche, se comporterait tout à fait différemment."
Des gouttelettes qui se solidifient
Le nucléole à l'intérieur du noyau cellulaire est également un condensat, qui apparaît comme une tache sombre diffuse au microscope. C'est là que de nombreuses protéines à queue chargée positivement aiment s'attarder. Beaucoup d'entre elles fournissent la machinerie nécessaire à la synthèse des protéines, ce qui rend ce condensat essentiel aux fonctions cellulaires.
La protéine mutante HMGB1, avec sa queue moléculaire chargée positivement, est également attirée par le nucléole, comme l'a observé l'équipe lors d'expériences avec des protéines isolées et des cultures cellulaires.
Mais comme la région de la protéine mutée a également gagné une partie huileuse et collante, elle a tendance à s'agglutiner. Le nucléole perd ses propriétés fluides et se solidifie de plus en plus, ce que Niskanen a pu observer au microscope. Les fonctions vitales des cellules s'en trouvaient altérées : avec la protéine mutée, un plus grand nombre de cellules dans une culture mouraient par rapport à une culture de cellules sans la mutation.
Recherche dans les bases de données
L'équipe de recherche a ensuite fouillé les bases de données génomiques de milliers d'individus à la recherche d'incidents similaires. En fait, les scientifiques ont pu identifier plus de six cents mutations similaires dans 66 protéines, dans lesquelles le cadre de lecture avait été déplacé par une mutation dans la queue de la protéine, la rendant à la fois plus chargée positivement et plus "grasse". Parmi ces mutations, 101 avaient déjà été associées à plusieurs troubles différents.
Pour un essai en culture cellulaire, l'équipe a sélectionné 13 gènes mutants. Dans 12 cas sur 13, les protéines mutantes avaient une préférence pour la localisation dans le nucléole. Environ la moitié des protéines testées altèrent la fonction du nucléole, ce qui ressemble au mécanisme de la maladie du syndrome BPTA.
De nouvelles explications pour des maladies existantes
"Pour la recherche clinique, notre étude pourrait avoir un effet révélateur", déclare Malte Spielmann, qui a dirigé les recherches avec Denes Hnisz et Denise Horn. "À l'avenir, nous pourrons certainement élucider les causes de certaines maladies génétiques et, espérons-le, les traiter un jour."
Cependant, "les maladies génétiques congénitales telles que le BPTAS sont presque impossibles à soigner, même avec nos nouvelles connaissances", déclare Denise Horn. "Comme les malformations se développent déjà dans l'utérus, il faudrait les traiter avec des médicaments avant qu'elles ne se développent. Cela serait très difficile à réaliser."
Mais les maladies tumorales sont aussi majoritairement déterminées par la génétique, ajoute Hnisz : "Les condensats cellulaires et la séparation de phase associée sont un mécanisme fondamental de la cellule qui joue également un rôle dans le cancer. Les chances de développer des thérapies ciblées dans ce domaine sont bien meilleures."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.