Une protéine au clair de lune rend un germe hospitalier nuisible
Une équipe de recherche identifie une approche potentielle pour de nouveaux traitements contre les infections à Pseudomonas aeruginosa
La bactérie Pseudomonas aeruginosa est un germe hospitalier répandu et dangereux. Elle infecte les voies respiratoires et les poumons et possède une résistance naturelle à de nombreux antibiotiques. On recherche actuellement ce que l'on appelle des pathoblockers afin de pouvoir mieux combattre la bactérie à l'avenir. Il ne s'agit pas de tuer l'agent pathogène, comme dans le cas d'un traitement antibiotique, mais d'éliminer spécifiquement ou d'améliorer son effet pathogène. Lors d'une infection par Pseudomonas aeruginosa, la pyocyanine, produit métabolique bleu-vert, contribue entre autres à l'émergence de processus inflammatoires et a un effet destructeur sur les tissus. L'infection serait moins grave si la production de cette substance pouvait être empêchée au moyen d'un pathobloquant. Pour cela, il faut d'abord comprendre les mécanismes moléculaires exacts responsables de la production de pyocyanine dans la cellule bactérienne. L'équipe de recherche dirigée par le professeur Wulf Blankenfeldt, qui dirige le département "Structure et fonction des protéines" du Centre Helmholtz de recherche sur les infections (HZI) de Braunschweig, a récemment découvert plus de détails sur l'interaction des protéines nécessaire à la production de pyocyanine en utilisant des méthodes modernes d'analyse biochimique des protéines. Au cours de ce travail, il a pu clarifier la fonction centrale d'une protéine appelée PqsE en tant que "moonlighter" dans ce processus. L'étude est publiée dans le numéro actuel de Nature Communications.
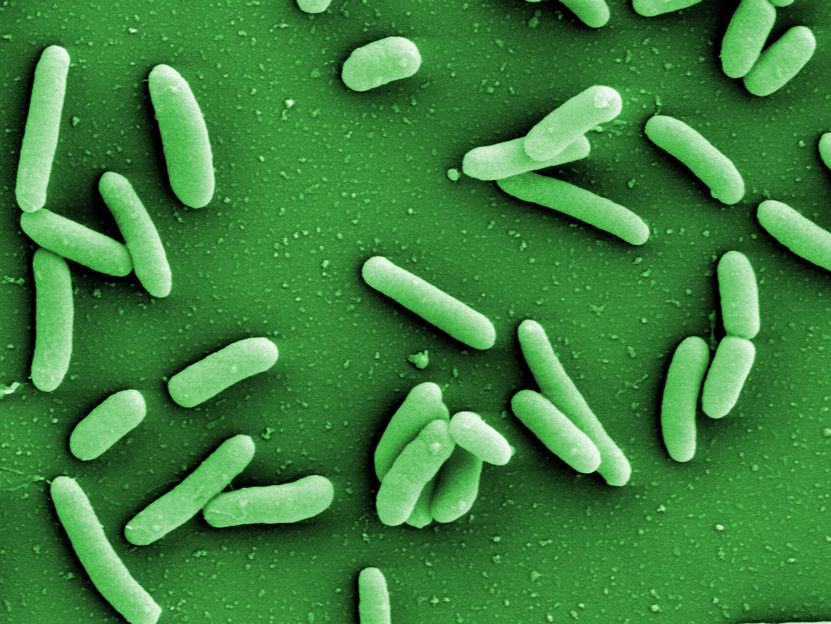
Pseudomonas aeruginosa
HZI/Manfred Rohde
Dans notre entretien, Wulf Blankenfeldt explique ce qui rend la bactérie Pseudomonas aeruginosa si dangereuse, pourquoi il ne s'est jamais désintéressé de la fonction de PqsE pendant plus de deux décennies - et comment il a pu mettre en évidence le travail au noir de cette protéine.
Professeur Blankenfeldt, où peut-on être infecté par Pseudomonas aeruginosa et qui court un risque particulier ?
Wulf Blankenfeldt : On peut être infecté par cette bactérie pathogène très répandue presque partout. Elle aime les environnements humides - et il y a pas mal d'endroits où elle peut être présente : par exemple, dans le sol ou l'eau à l'extérieur. Mais elle se sent aussi très à l'aise dans l'eau du robinet, les lavabos, les lave-vaisselle, les douches ou les toilettes, tous les endroits où il est facile d'être infecté si les mesures d'hygiène ne sont pas parfaites à 100 %. Et il est également transmissible d'une personne à l'autre. Pour les personnes dont le système immunitaire est affaibli ou qui souffrent de maladies respiratoires graves comme la mucoviscidose ou la bronchopneumopathie chronique obstructive (BPCO), une infection peut s'avérer très dangereuse et parfois même mortelle. Malheureusement, Pseudomonas aeruginosa s'est également fait un nom en tant que germe hospitalier.
Pourquoi de nombreux antibiotiques sont-ils inefficaces contre ce germe ?
Pseudomonas aeruginosa peut expulser sélectivement des substances étrangères telles que des médicaments de l'intérieur de sa cellule et fait partie des bactéries qui forment ce que l'on appelle un biofilm. Ces bactéries s'entourent d'une sorte de couche muqueuse qui leur offre un certain degré de protection, par exemple contre les antibiotiques. Cela rend Pseudomonas aeruginosa naturellement résistant à un grand nombre d'antibiotiques et donc difficile à combattre. La mise au point de pathobloquants efficaces, capables de réduire ou d'éliminer l'influence de l'agent pathogène, serait une véritable aubaine.
Il serait utile de désactiver le produit métabolique pyocyanine, qui endommage les tissus et qui est produit par l'agent pathogène. Quel rôle les protéines étudiées dans votre étude jouent-elles à cet égard ?
La pyocyanine n'est produite qu'après la lecture des gènes nécessaires à sa production. Et ce processus de lecture est contrôlé par une interaction de différentes protéines. Au cœur de ce processus se trouve une protéine appelée RhlR. On sait depuis longtemps que RhlR ne commence à lire les gènes que lorsque la molécule de signalisation C4-HSL donne le feu vert et se lie à RhlR. Mais on ne savait pas jusqu'à présent si, et surtout comment, d'autres protéines pouvaient être impliquées dans cette cascade de signalisation.
Mais vous aviez déjà un suspect en ligne de mire...
(rires) Exactement - même un suspect de longue date ! Il y a une vingtaine d'années, mon équipe et moi avons commencé à travailler sur une protéine appelée PqsE, dont on pensait qu'elle était associée à la production de pyocyanine. À l'époque, nous avons pu élucider sa structure cristalline, entre autres choses. Puis, il y a environ cinq ans, nous avons obtenu la première preuve en laboratoire que la protéine RhlR, intrinsèquement assez instable, est stabilisée en se liant à la PqsE. Depuis lors, il m'est apparu évident que la PqsE pouvait également être directement impliquée dans l'activation des gènes de la pyocyanine, mais je n'ai pas encore pu le prouver.
Maintenant vous avez réussi comme le montre votre récente étude dans Nature Communications !
Oui, enfin ! Grâce à des méthodes assistées par ordinateur très sophistiquées qui n'ont été développées que récemment. Cela n'aurait pas été possible dans le passé. Nous avons utilisé un logiciel israélien pour concevoir sur ordinateur une protéine RhlR artificielle qui devrait être stable par elle-même et conserver toute sa fonction dans la lecture des gènes. Nous avons ensuite fait produire le plan d'ADN par une entreprise et avons ensuite examiné la protéine artificielle dans notre laboratoire. Dans notre étude, nous avons testé si la RhlR synthétique stabilisée était capable de lancer la lecture du gène pour la production de pyocyanine même en l'absence de PqsE. Et voilà : C'était exactement le cas ! En revanche, dans des expériences comparatives, le RhlR naturel était incapable de lire les gènes en l'absence de PqsE, et aucune pyocyanine n'était produite. Nous avons donc pu montrer qu'un RhlR stable est nécessaire au processus de lecture - et que la protéine PqsE en est responsable en s'associant au RhlR pour former un complexe.
Cependant, la PqsE vous avait auparavant conduit, vous et vos collègues chercheurs internationaux, sur le chemin du jardin...
Oui, c'est vrai ! La PqsE avait été classée dans le groupe des thioestérases sur la base de ses propriétés d'enzyme, c'est-à-dire des protéines qui accélèrent les processus (bio)chimiques. On a donc supposé que ses activités en tant qu'enzyme entreraient également en jeu d'une manière ou d'une autre en ce qui concerne la pyocyanine. Mais l'effet stabilisateur que la PqsE exerce sur RhlR n'a absolument rien à voir avec son activité enzymatique. En fait, la PqsE nous a mené sur une fausse piste pendant longtemps. Mais heureusement, nous sommes désormais en mesure de signaler officiellement qu'elle joue le rôle de stabilisateur de RhlR, et nous pourrions même être en mesure de l'arrêter à l'avenir.
Les protéines de Pseudomonas aeruginosa vont-elles continuer à vous occuper ?
Sans aucun doute. Elles ne m'ont pas lâché depuis vingt ans, et je pense qu'il y aura encore de nombreuses années à venir - et cela devient vraiment passionnant maintenant. Grâce à des méthodes modernes comme la cristallographie des protéines, nous avons pu visualiser le complexe protéique RhlR-PqsE en 3D dans notre étude. C'est une excellente base pour rechercher, avec nos collègues du HZI, des substances actives qui interfèrent spécifiquement avec cette interaction et pourraient être utilisées comme pathobloquants. Nous travaillons déjà sur une procédure de criblage et espérons que nos futures recherches continueront à contribuer à l'identification de nouvelles approches thérapeutiques pouvant être appliquées avec succès dans les infections à Pseudomonas.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Sebastian Roman Borgert, Steffi Henke, Florian Witzgall, Stefan Schmelz, Susanne zur Lage, Sven-Kevin Hotop, Steffi Stephen, Dennis Lübken, Jonas Krüger, Nicolas Oswaldo Gomez, Marco van Ham, Lothar Jänsch, Markus Kalesse, Andreas Pich, Mark Brönstrup, Susanne Häussler & Wulf Blankenfeldt: Moonlighting chaperone activity of the enzyme PqsE contributes to RhlR-controlled virulence of Pseudomonas aeruginosa. Nature Communications 2022