Médicaments avec des chaînes de sucre
La spectrométrie de masse descendante native révèle le rôle des glycanes dans les oligomères de protéines
De nombreuses protéines contiennent des motifs de molécules de sucre (glycanes) et sont constituées de plusieurs sous-unités agrégées. Cette glycosylation et cette oligomérisation ont une influence décisive sur la fonction des protéines et doivent être prises en compte dans le développement biopharmaceutique. Dans la revue Angewandte Chemie, une équipe britannique a présenté une approche basée sur la spectroscopie de masse (MS) descendante native qui peut être utilisée pour analyser l'interaction entre la glycosylation et l'oligomérisation dans diverses hormones thérapeutiques et cytokines.
(c) Wiley-VCH
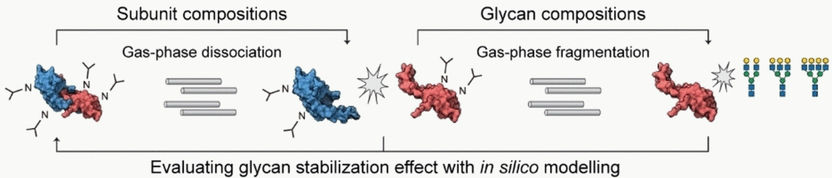
Dans la MS conventionnelle, les molécules se brisent en fragments, mais la MS native permet d'examiner les oligomères protéiques repliés liés aux glycanes. Dans la méthode descendante, les oligomères sont ensuite séparés au moyen d'une dissociation en phase gazeuse et mesurés. Dans une dernière étape, la fragmentation en phase gazeuse est utilisée pour séparer et analyser les glycanes. Pour un complexe protéique donné, il est ainsi possible de déterminer les proportions de monomères et d'oligomères présents - que ce soit dans un organisme ou dans un lot de médicaments - ainsi que les différents schémas de glycosylation et leurs quantités.
Carol V. Robinson et Di Wu, de l'université d'Oxford (Royaume-Uni), se sont concentrés sur les glycanes qui sont situés à l'interface entre deux sous-unités et qui peuvent jouer un rôle important dans l'oligomérisation. Ils ont comparé les résultats de leurs mesures avec un modèle théorique calculé sur la base des sous-unités dissociées. Cela a permis de tirer des conclusions sur l'effet stabilisateur des glycanes.
L'une des glycoprotéines thérapeutiques qu'ils ont étudiées est l'interféron-β (IFN-β), une cytokine anti-inflammatoire utilisée pour traiter des maladies telles que la sclérose en plaques. L'IFN-β1a forme un homodimère asymétrique. Les analyses MS ont montré que la plupart des formes primaires du monomère et du dimère sont glycosylées. Cependant, pour cette cytokine, la dimérisation est indépendante du statut de glycosylation.
Les choses sont différentes pour le facteur de nécrose tumorale-α (TNF-α), une cytokine inflammatoire. Les produits biopharmaceutiques à base d'anticorps qui neutralisent le TNF-α sont utilisés en cas de maladie auto-immune, comme la polyarthrite rhumatoïde, la maladie de Crohn et le psoriasis. Le TNF-α est un homotrimère avec un glycan à l'interface de chaque sous-unité. Les analyses MS, et les expériences avec une petite molécule qui perturbe la trimérisation, ont indiqué que les glycanes stabilisent significativement le trimère du TNF-α.
Robinson et Wu ont également étudié l'hormone folliculo-stimulante (FSH, follitropine), un hétérodimère composé de sous-unités α et β. Les médicaments à base de follitropine α sont utilisés pour les traitements de la fertilité. L'équipe a découvert une distribution inhabituelle de glycanes sur la sous-unité α. L'un de ces glycanes interagit largement avec la sous-unité β et est clairement impliqué dans la régulation de la dimérisation.
Les connaissances acquises grâce aux expériences de MS descendante native pourraient aider à adapter les glycanes dans les protéines thérapeutiques afin d'améliorer leur stabilité et leur efficacité.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.