Retour vers le futur de la photosynthèse
Les voyages scientifiques dans le temps peuvent fournir des informations précieuses pour l'avenir
Le biocatalyseur central de la photosynthèse, la Rubisco, est l'enzyme la plus abondante sur terre. Mais comment la Rubisco a-t-elle évolué et comment s'est-elle adaptée aux changements environnementaux au cours de l'histoire de la Terre ? En reconstituant des enzymes vieilles de plusieurs milliards d'années, une équipe de chercheurs de Max Planck a déchiffré l'une des adaptations clés de la photosynthèse primitive. Leurs résultats ne donnent pas seulement un aperçu de l'évolution de la photosynthèse moderne, mais offrent également de nouvelles impulsions pour l'améliorer.
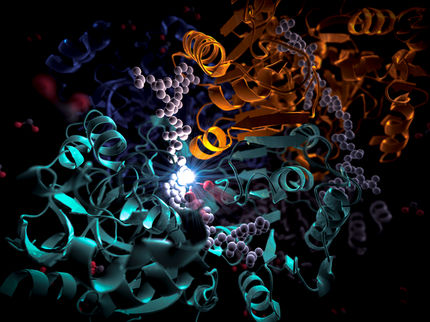
Impression d'artiste des Rubiscos primordiaux avant et après le développement d'une nouvelle sous-unité, avec des molécules d'oxygène et de dioxyde de carbone circulant vers leurs sites actifs.
© Max Planck Institute for Terrestrial Microbiology/Hochberg
La vie actuelle dépend entièrement d'organismes photosynthétiques comme les plantes et les algues qui captent et transforment le CO2. Au cœur de ces processus se trouve une enzyme appelée Rubisco qui capte plus de 400 milliards de tonnes de CO2 par an. Les organismes vivants actuels en produisent des quantités stupéfiantes : la masse de Rubisco sur notre planète dépasse celle de tous les humains. Afin d'assumer un rôle aussi dominant dans le cycle global du carbone, la Rubisco a dû s'adapter en permanence à des conditions environnementales changeantes. Grâce à une combinaison d'approches informatiques et synthétiques, une équipe de l'Institut Max-Planck de microbiologie terrestre de Marbourg, en Allemagne, en collaboration avec l'université de Singapour, a réussi à ressusciter et à étudier en laboratoire des enzymes vieilles d'un milliard d'années. Au cours de ce processus, qu'ils qualifient de "paléontologie moléculaire", les chercheurs ont découvert qu'au lieu de mutations directes dans le centre actif, un composant entièrement nouveau préparait la photosynthèse à s'adapter à l'augmentation du taux d'oxygène.
La confusion des débuts de la Rubisco
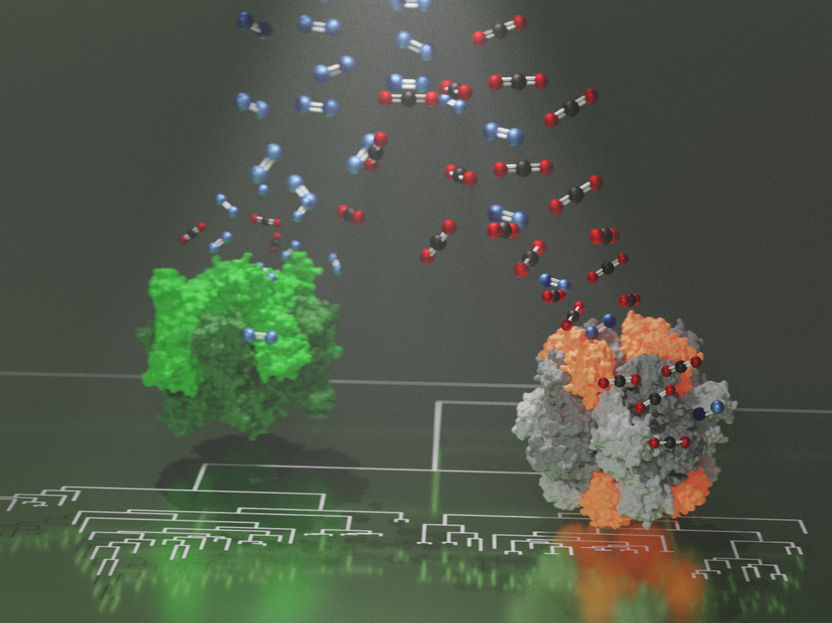
La rubisco est ancienne : elle est apparue il y a environ quatre milliards d'années dans le métabolisme primordial, avant la présence de l'oxygène sur terre. Cependant, avec l'invention de la photosynthèse et l'augmentation de la teneur en oxygène dans l'atmosphère, l'enzyme a commencé à catalyser une réaction indésirable, dans laquelle elle confond O2 et CO2 et produit des métabolites toxiques pour la cellule. Cette confusion dans le champ d'application du substrat affecte encore les Rubiscos à ce jour et limite l'efficacité de la photosynthèse. Même si les Rubiscos qui ont évolué dans des environnements contenant de l'oxygène sont devenus plus spécifiques au CO2 au fil du temps, aucun d'entre eux n'a pu se débarrasser complètement de la réaction de capture de l'oxygène.
Les déterminants moléculaires de la spécificité accrue de la Rubisco pour le CO2 restent largement inconnus. Ils sont pourtant d'un grand intérêt pour les chercheurs qui cherchent à améliorer la photosynthèse. Il est intéressant de noter que les Rubiscos qui présentent une spécificité accrue pour le CO2 ont recruté un nouveau composant protéique de fonction inconnue. Ce composant a été soupçonné d'être impliqué dans l'augmentation de la spécificité au CO2, cependant, la véritable raison de son apparition est restée difficile à déterminer car il a déjà évolué il y a des milliards d'années.
Étudier l'évolution en ressuscitant d'anciennes protéines en laboratoire
Pour comprendre cet événement clé dans l'évolution de Rubiscos plus spécifiques, des collaborateurs de l'Institut Max Planck de microbiologie terrestre de Marbourg et de l'Université technologique de Nanyang à Singapour ont utilisé un algorithme statistique pour recréer des formes de Rubiscos qui existaient il y a des milliards d'années, avant que les niveaux d'oxygène ne commencent à augmenter.
L'équipe dirigée par les chercheurs de Max Planck, les professeurs Tobias Erb et Georg Hochberg, a ressuscité ces protéines anciennes en laboratoire pour étudier leurs propriétés. En particulier, les scientifiques se sont demandé si le nouveau composant de la Rubisco avait quelque chose à voir avec l'évolution d'une plus grande spécificité.
La réponse a été surprenante, comme l'explique le chercheur doctorant Luca Schulz : "Nous nous attendions à ce que le nouveau composant exclue en quelque sorte directement l'oxygène du centre catalytique de la Rubisco. Ce n'est pas ce qui s'est passé. Au contraire, cette nouvelle sous-unité semble agir comme un modulateur de l'évolution : le recrutement de la sous-unité a modifié l'effet que les mutations ultérieures ont eu sur la sous-unité catalytique de la Rubisco. Des mutations auparavant sans conséquence ont soudainement eu un effet énorme sur la spécificité lorsque ce nouveau composant était présent. Il semble que la présence de cette nouvelle sous-unité ait complètement modifié le potentiel évolutif de la Rubisco."
L'addiction d'une enzyme à sa nouvelle sous-unité
Cette fonction de "modulateur évolutif" explique également un autre aspect mystérieux du nouveau composant protéique : Les rubiscos qui l'ont incorporé en sont totalement dépendants, alors que d'autres formes de rubisco peuvent parfaitement fonctionner sans. Le même effet modulateur en explique la raison : Lorsqu'elle est liée à ce petit composant protéique, la Rubisco devient tolérante à des mutations qui, autrement, seraient catastrophiquement préjudiciables. Avec l'accumulation de telles mutations, la Rubisco devient effectivement dépendante de sa nouvelle sous-unité.
Dans l'ensemble, ces résultats, publiés récemment dans la revue "Science", expliquent enfin pourquoi la Rubisco a conservé ce nouveau composant protéique depuis qu'elle l'a rencontré. Georg Hochberg, chef du groupe de recherche Max Planck, explique : "Le fait que ce lien n'ait pas été compris jusqu'à présent souligne l'importance de l'analyse évolutive pour comprendre la biochimie qui anime la vie autour de nous. L'histoire de biomolécules comme la Rubisco peut nous apprendre beaucoup de choses sur les raisons pour lesquelles elles sont ce qu'elles sont aujourd'hui. Et il y a encore tellement de phénomènes biochimiques dont nous n'avons aucune idée de l'histoire de l'évolution. C'est donc une période très excitante pour les biochimistes évolutionnistes : la quasi-totalité de l'histoire moléculaire de la cellule reste à découvrir."
Les voyages scientifiques dans le temps peuvent fournir des informations précieuses pour l'avenir.
L'étude a également des implications importantes sur la façon dont la photosynthèse pourrait être améliorée, explique Tobias Erb, biologiste synthétique et directeur de Max Planck : "Nos recherches nous ont appris que les tentatives traditionnelles d'amélioration de la Rubisco ne cherchaient peut-être pas au bon endroit : pendant des années, la recherche s'est concentrée uniquement sur la modification des acides aminés de la Rubisco elle-même pour l'améliorer. Nos travaux suggèrent maintenant que l'ajout de composants protéiques entièrement nouveaux à l'enzyme pourrait être plus productif et pourrait ouvrir des voies d'évolution autrement impossibles. C'est une terre inconnue pour l'ingénierie des enzymes, et nous sommes impatients de voir où elle nous mènera."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.