Une approche innovante de la liaison cellulaire pourrait nous aider à comprendre les maladies
La liaison ligand-récepteur est importante pour les processus biologiques tels que l'immunité et les maladies infectieuses. Par exemple, le leucocyte peut pénétrer dans un tissu lésé en se liant à la sélectine P sur les cellules endothéliales. Le COVID-19 est dû à la liaison entre les pics viraux et l'enzyme 2 de conversion de l'angiotensine (ACE2) sur les cellules hôtes. Des tests unicellulaires de différents types ont été développés pour étudier la cinétique de liaison ou d'adhésion.
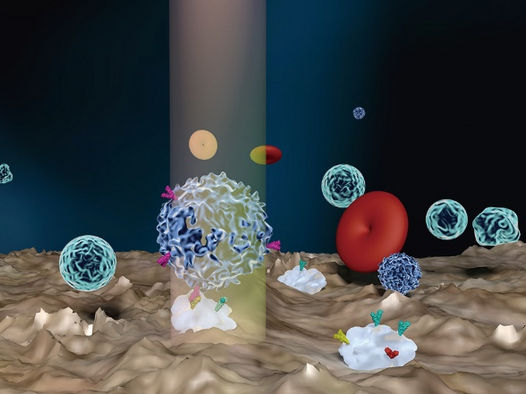
L'essai de fréquence d'adhésion rotationnelle à cellule unique (scRAFA) mesure la cinétique d'adhésion des cellules qui subissent une rotation hors du plan sous l'effet de la lumière à proximité du substrat.
by Yaoran Liu, Ongru Ding, Jingang Li, Xin Lou, Mingcheng Yang, Yuebing Zheng
Cependant, la différence dans les liaisons mesurées entre la sélectine P et l'ACE2 entre les méthodes est significative. Elle provient du fait que les échantillons mesurés ont des longueurs différentes de molécules en interaction, de molécules de liaison, ou du schéma d'immobilisation des molécules. Cela affecte la cinétique de dissociation des liaisons. Les méthodes existantes mesurent la force de traction dans la direction normale de l'interface cellulaire en se basant sur la rupture du contact adhésif. Ces méthodes sont loin de correspondre aux conditions réelles d'adhésion cellulaire in vivo .
L'adhésion cellulairein vivo est plus complexe que ce que les méthodes existantes peuvent mesurer. Initialement, une cellule va se pré-adhérer dans une direction inclinée. La cellule subit ensuite une force de cisaillement induite par l'écoulement du fluide, ce qui permet au récepteur et au ligand de glisser l'un contre l'autre. Ce glissement favorise la formation de nouvelles interactions après la rupture de l'attachement préexistant. La direction de la force entre le ligand et le récepteur est tangentielle à la cellule ou parallèle au substrat, ce qui entraîne différents comportements d'adhésion cellulaire.
Des études préliminaires ont montré que les intégrines ont besoin d'une force latérale pour médier les interactions cellule-cellule. Les récepteurs des cellules T peuvent générer une force tangentielle à l'interface de contact. Les chambres microfluidiques ont été adaptées pour étudier cette condition avec le flux de cisaillement contrôlé par une pompe.
Les essais en chambre à écoulement, utilisant les techniques actuelles, ne peuvent pas contrôler précisément la distance cellule-substrat. Ils ne peuvent pas non plus cibler une cellule spécifique en raison de la distribution aléatoire des cellules dans le flux. Ils ne peuvent analyser que la cinétique d'adhésion d'une fraction des cellules qui subissent aléatoirement des processus de roulement sous l'écoulement microfluidique. Il n'y a pas de contrôle du temps de mesure de l'adhésion avec le test de la chambre d'écoulement. Ce temps est généralement équivalent à la période entre le contact de la cellule avec la paroi de la chambre et la formation par la cellule de la liaison initiale avec la paroi, ce qui limite la précision de l'analyse de l'adhésion cellulaire.
Dans un nouvel article publié dans eLight, une équipe de scientifiques dirigée par le professeur associé Yuebing Zheng de l'université du Texas à Austin a étudié le contrôle des récepteurs de surface des cellules. Leur article, intitulé "Light-driven single-cell rotational adhesion frequency assay", a démontré une technique unique qui pourrait changer radicalement l'approche de la science dans ce domaine.
Elle a permis de quantifier, sans marquage et avec une résolution subcellulaire, l'adhésion de presque toutes les cellules individuelles ciblées dans des solutions cliniques. La scRAFA de l'équipe a mesuré les forces d'adhésion des cellules qui subissent une rotation hors plan induite par la lumière à proximité du substrat. Leur approche est très différente de l'approche traditionnelle qui consiste à mesurer la cinétique d'adhésion en rompant le contact adhésif dans la direction normale,
Les chercheurs ont ciblé des cellules spécifiques grâce à une fusion transparente de la rotation optique et du piégeage sur une seule plateforme. Cela a permis à l'équipe de surveiller en permanence le processus complet d'adhésion des cellules, de l'initiation de la liaison avec le substrat à la formation d'un attachement permanent. Elle a également pu contrôler avec précision la distance d'interaction entre les ligands du substrat et les récepteurs cellulaires afin de mesurer pour la première fois la cinétique de l'adhésion latérale. Ainsi, scRAFA permet de mesurer in situ avec une grande précision les forces d'adhésion par cisaillement sur les cellules ciblées dans des échantillons cliniques complexes.
Le scRAFA, piloté par la lumière, dispose d'une série de capacités intégrées dans un seul système, notamment le piégeage optique, la rotation, l'imagerie et la spectroscopie. Leur scRAFA peut localiser des organismes ciblés dans des fluides complexes pour la mesure de l'adhérence. Il peut également identifier des caractérisations optiques supplémentaires des structures et autres fonctions des organismes. Cette fonctionnalité simplifie l'établissement de relations structure-fonction complètes au niveau d'un seul organisme.
Mesures de l'adhérence rotationnelle et de la force de cisaillement pour les cellules ayant des surfaces homogènes et hétérogènes. La capacité de révéler l'hétérogénéité structurelle et fonctionnelle d'une cellule unique est cruciale pour étudier les microdomaines, les regroupements et les liens cellulaires. L'analyse de l'adhésion est également essentielle pour comprendre la réponse immunitaire et l'infection bactérienne.
Plus important encore, leur scRAFA peut être appliquée à des organismes dans différentes conditions physiologiques. Elle peut même révéler les comportements d'adhésion dépendant de la force de cisaillement grâce à l'écoulement fluidique et au couple de rotation accordables de la puissance laser. L'étude initiale a montré que leur scRAFA pouvait distinguer les comportements d'adhésion entre les cellules de levure cultivées et celles des échantillons cliniques.
Les applications plus larges du scRAFA nécessiteront une modélisation plus poussée des organismes et de leurs interactions avec les substrats. Grâce à ses performances supérieures et à son applicabilité générale, le scRAFA pourrait jouer un rôle essentiel dans des domaines allant de la biologie cellulaire à l'immunothérapie en passant par les infections des voies urinaires.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.





































