Rendre l'invisible visible - Découverte d'un mécanisme en deux étapes permettant au système immunitaire inné de détecter précocement des virus comme le VIH
La compréhension de ce mécanisme pourrait être utile pour le développement de vaccins contre le SIDA
Des chercheurs de l'Institut Paul-Ehrlich participant à un réseau de recherche international ont découvert un mécanisme en deux étapes du système immunitaire inné qui permet également de reconnaître spécifiquement le VIH (virus de l'immunodéficience humaine) et de déclencher une réponse immunitaire précoce. Ces connaissances pourraient être utilisées pour le développement de vaccins susceptibles de renforcer ce mécanisme. L'organisme pourrait ainsi produire efficacement et précocement sa propre défense contre le VIH.
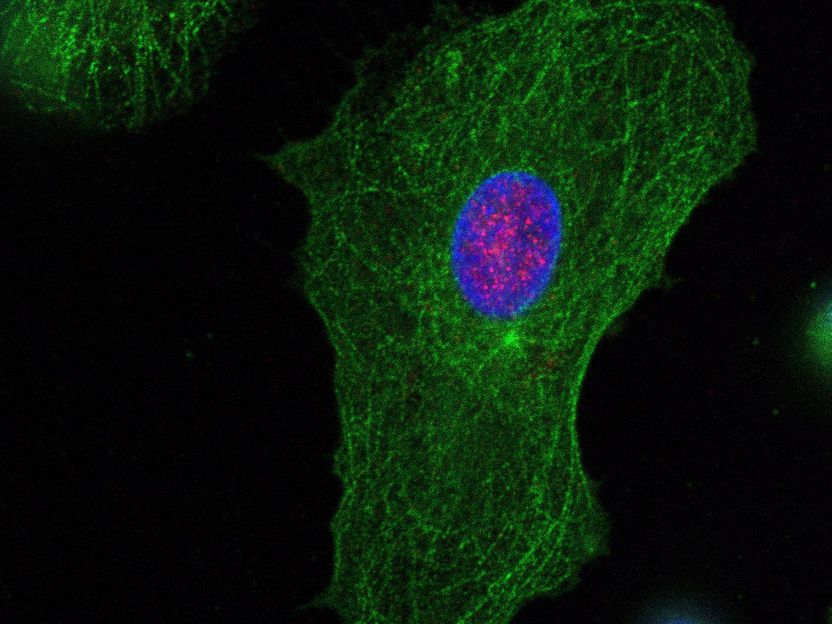
Cellules dendritiques dérivées de monocytes (MDDC) provenant d'un donneur sain, colorées pour PQBP1 (rouge) et le composant structurel cellulaire tubuline-beta (vert). Le compartiment nucléaire est coloré en bleu.
N. Hein-Fuchs / Paul-Ehrlich-Institut
Le virus de l'immunodéficience humaine VIH-1 appartient à la famille des lentivirus, qui pose des défis particuliers à la médecine. Le VIH provoque le sida, une maladie infectieuse chronique à progression lente, en contournant les mécanismes de défense du système immunitaire.
Toutefois, le système immunitaire semble avoir la capacité de détecter le VIH à un stade précoce. Les chercheurs de l'Institut Paul-Ehrlich ont participé à un réseau de recherche international coordonné par le Dr Chanda et le Dr Yoh au Sanford Burnham Prebys Medical Discovery Institute à La Jolla, en Californie. Avec des collègues de New York, Chicago, Sydney et New Haven, ils ont pu acquérir de nouvelles connaissances sur le système immunitaire. Le réseau de recherche a pu élucider le mécanisme par lequel l'information génétique, l'ADN du virus VIH dans la cellule, peut être reconnue comme étrangère et déclencher ainsi un mécanisme de défense. Le virus VIH est un virus à ARN. Après avoir pénétré dans une cellule, une seule copie d'ADN provenant du génome ARN est synthétisée dans le virus VIH puis intégrée dans le génome de l'hôte. Ainsi, il est traité par la cellule comme un gène cellulaire normal et reste invisible pour le système de défense de l'hôte.
Comment le mécanisme de surveillance cellulaire peut-il détecter cette petite quantité d'ADN, qui ne se produit que temporairement ? Les scientifiques ont identifié un mécanisme en deux étapes, jusqu'alors inconnu, qui rend cela possible. Dans la première étape, un récepteur identifié en 2015, la protéine de liaison polyglutamine 1 (PQBP1), marque la capside virale intacte. La capside est la structure protéique utilisée pour emballer le génome viral. La protéine capteur d'ADN déjà connue, appelée GMP-AMP synthase cyclique (cGAS), est nécessaire à la deuxième étape. À ce stade, le virus VIH convertit son ARN en ADN au cours du processus de transcription inverse et la capside virale commence à se décomposer.
Cette reconnaissance en deux étapes de la protéine pathogène (capside du VIH) et de l'ADN pathogène (ADN du VIH) garantit que l'activation ultérieure des voies de signalisation immunitaire (via l'interféron, IFN) n'est pas activée spontanément par un seul composant. Cela permet d'éviter que les propres structures de l'organisme ne soient accidentellement attaquées. Si l'activation a lieu après cette double détection, une réaction inflammatoire puissante et ciblée est déclenchée. Cela déclenche une réponse robuste aux "vraies" espèces d'ADN étrangères et permet en même temps d'éviter une auto-activation indésirable de l'ADN hôte.
L'étude coopérative offre non seulement de nouvelles perspectives sur la détection cellulaire innée des virus de la famille des lentivirus, mais illustre également la manière dont les capteurs dans les cellules peuvent être dirigés, via des facteurs et des mécanismes de contrôle supplémentaires, vers des motifs moléculaires associés aux agents pathogènes (PAMP) spécifiques et éventuellement rares ou de courte durée de vie, présents dans les microbes. D'autres agents pathogènes pourraient également être détectés de manière très ciblée et efficace en suivant ce concept.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Yoh SM, Mamede JI, Lau D, Ahn N, Sánchez-Aparicio MT, Temple J, Tuckwell A, Fuchs NV, Cianci GC, Riva L, Curry H, Yin X, Gambut S, Simons LM, Hultquist JF, König R, Xiong Y, García-Sastre A, Böcking T, Hope TJ, Chanda SK (2022): Recognition of HIV-1 capsid by PQBP1 licenses an innate immune sensing of nascent HIV-1 DNA. Mol Cell Jul 8 [Epub ahead of print].

































