Le "sélénosome" : La chorégraphie qui régit le recodage
La microscopie cryo-électronique permet de visualiser les structures cellulaires
Une équipe dirigée par des chercheurs de la Charité - Universitätsmedizin Berlin a réussi à décrypter un processus fondamental de la biologie moléculaire : l'incorporation de la sélénocystéine - le "21e acide aminé" - dans des protéines contenant du sélénium, appelées sélénoprotéines. Ces constructions protéiques sont essentielles à la survie de l'homme et d'autres mammifères, ainsi que de certains micro-organismes. Cependant, la manière précise dont ces protéines sont synthétisées et assemblées dans notre corps est restée inconnue jusqu'à présent. Dans la revue Science, les auteurs fournissent la première description détaillée de la manière dont une poche de liaison spécifique interagit avec d'autres facteurs pour faciliter ce processus.
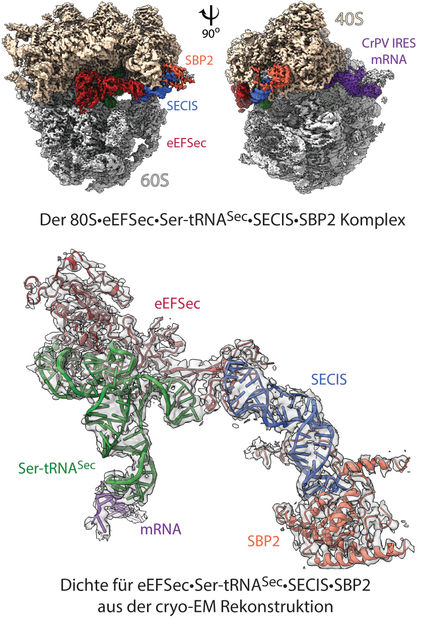
Structure du "sélénosome" : reconstruction cryo-microscopique électronique 3D du complexe ribosomal à une résolution de 2,8 Å (en haut). L'image montre les sous-unités 40S et 60S du ribosome, avec un marquage indiquant les éléments de liaison (ligands) : ARNm et autres facteurs contributifs. Dans le modèle (ci-dessous), la densité mise en évidence pour les facteurs eEFSec-Ser-tRNASec-SECIS-SBP2 montre comment les éléments individuels sont disposés au sein du ribosome 80S, et comment le recodage est réalisé.
© Charité | C. M. T. Spahn
Les sélénoprotéines constituent un groupe inhabituel de protéines qui n'ont été découvertes que relativement récemment. Les scientifiques estiment qu'il existe jusqu'à 50 de ces protéines, mais seules certaines d'entre elles ont été étudiées. Toutes les sélénoprotéines ont des structures complexes qui s'articulent autour d'au moins une partie de l'acide aminé qui leur donne leur nom : la sélénocystéine (Sec). Les sélénoprotéines jouent un rôle important de protection et de défense dans le corps humain, tant au niveau cellulaire qu'au niveau de l'organisme. Elles fonctionnent principalement comme des oxydoréductases, c'est-à-dire des médiateurs de réactions chimiques clés, et comme des médiateurs de la fonction thyroïdienne. On pense également que les sélénoprotéines contribuent à protéger l'organisme contre le cancer, car elles contiennent l'élément sélénium, qui est capable de réduire rapidement le stress oxydatif.
Comment ces protéines spéciales sont-elles formées ? Quelle est la chorégraphie moléculaire qui définit les étapes de l'incorporation de la sélénocystéine lors de la biosynthèse des protéines ? Quelle est la structure précise du sélénosome, le complexe qui se forme pour faciliter la synthèse des sélénoprotéines ? En collaboration avec des partenaires de l'Institut Max Planck de génétique moléculaire, de l'Université de l'Illinois à Chicago et de la Rutgers Robert Wood Johnson Medical School du New Jersey, l'équipe dirigée par le professeur Christian Spahn, directeur de l'Institut de physique médicale et de biophysique de la Charité, et le docteur Tarek Hilal, de l'Institut de chimie et de biochimie de l'Université libre de Berlin, a utilisé la cryomicroscopie électronique tridimensionnelle à haute résolution pour visualiser et comprendre les structures et les étapes de ce processus fondamental de la biologie moléculaire.
Les ribosomes, connus comme les usines à protéines de la cellule, synthétisent généralement les protéines en suivant des plans stricts fournis par les molécules d'ARN messager (ARNm). Le code génétique universel utilise des séquences spécifiques constituées de combinaisons de triplets (codons) de quatre bases différentes. Chaque codon forme une unité d'information génétique codant pour un acide aminé particulier. Cependant, la structure spécifique des sélénoprotéines nécessite plus que l'ensemble de base de 20 acides aminés. Toutes les sélénoprotéines contiennent de la sélénocystéine (Sec), qui est connue comme le 21e acide aminé.
La sélénocystéine n'a pas son propre codon désigné, ce qui signifie que, contrairement aux autres acides aminés, elle n'est pas codée par un triplet de bases spécifique. Les ribosomes doivent donc acquérir un ensemble de caractéristiques très particulières pendant la synthèse des sélénoprotéines. Le ribosome est reprogrammé par une séquence de signalisation spéciale de l'ARNm connue sous le nom d'élément SECIS (séquence d'insertion de la sélénocystéine), qui écrase effectivement le code génétique existant. Un codon spécifique - qui signale normalement la fin du processus de traduction et donc la libération de la chaîne protéique émergente (codon stop UGA) - est ainsi recodé pour insérer la sélénocystéine dans les protéines. Outre l'élément SECIS, ce processus de recodage nécessite également une espèce d'ARN de transfert spécifique (tRNASec) qui transporte la sélénocystéine et d'autres facteurs de traduction particuliers. "Bien que les acteurs impliqués soient connus depuis plusieurs années, leurs fonctions et interactions précises étaient restées un mystère jusqu'à présent", déclare le professeur Spahn, ajoutant : "Un mystère particulier était l'action précise de l'élément SECIS, qui n'est pas positionné à proximité immédiate du codon stop UGA recodé, mais à la toute fin de la séquence linéaire de l'ARNm, à plusieurs centaines de blocs de construction nucléotidiques de distance."
Afin d'élucider le mécanisme moléculaire en cause, les chercheurs ont commencé par recréer en laboratoire le "sélénosome", le complexe ribosomal qui se forme pour recoder le codon stop UGA. Grâce à une technologie d'imagerie à haute résolution connue sous le nom de microscopie cryo-électronique, les chercheurs ont ensuite produit une visualisation en 3D du minuscule complexe, ce qui leur a permis d'étudier sa structure. "Grâce à nos visualisations structurelles, nous avons ensuite pu déterminer comment les facteurs impliqués interagissent avec le ribosome et comment ces interactions reprogramment le ribosome", explique le professeur Spahn. "Plus précisément, nous avons pu montrer que l'ARNm forme une grande boucle, ce qui signifie que le codon stop UGA et l'élément SECIS se lient au ribosome en même temps. L'élément SECIS est ancré par une poche de liaison inconnue jusqu'alors sur le ribosome et, lorsqu'il est lié au ribosome, il peut favoriser l'insertion de la sélénocystéine avec l'aide de facteurs de traduction." La structure du sélénosome et son mécanisme ont surpris les chercheurs. Ni l'un ni l'autre n'auraient pu être prédits, car le processus d'insertion de la sélénocystéine chez l'homme et les autres mammifères est nettement différent de celui connu chez les bactéries. Le complexe décrit dans cette étude est un exemple de la manière dont les structures de signalisation situées à l'extrémité arrière du brin d'ARNm (c'est-à-dire en dehors de la région codante) peuvent interagir avec le ribosome afin de contrôler sa fonction.
Les chercheurs ont pu élucider la toute première étape du processus d'insertion de la sélénocystéine. Les étapes suivantes restent floues et feront l'objet de futures études. Des recherches comme celle-ci contribuent à améliorer notre compréhension de la fonction vitale de l'oligo-élément sélénium dans l'organisme, ainsi que de l'importance de son rôle dans la physiologie normale et le développement de maladies comme le diabète et le cancer.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.