Un mensajero inflamatorio alimenta el Alzheimer
La terapia combinada podría ralentizar el deterioro del cerebro
Investigadores de la Charité - Universitätsmedizin Berlin y del Centro Max Delbrück han detallado el mecanismo preciso a través del cual la molécula de señalización inflamatoria IL-12 contribuye a la enfermedad de Alzheimer. El estudio se publica en la revista Nature Aging*.
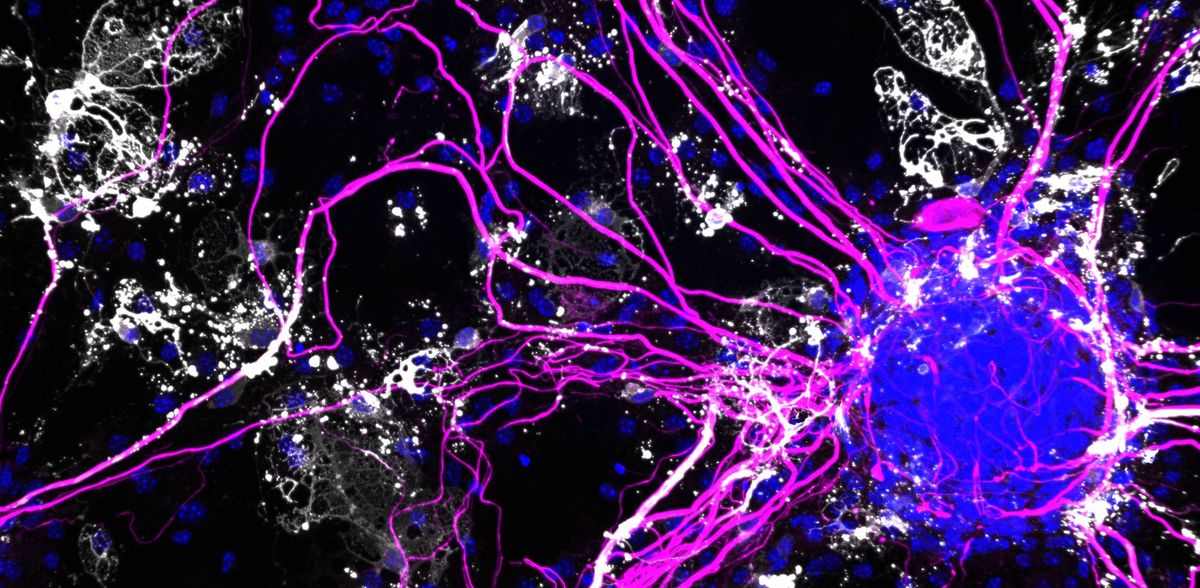
Las microglías, las células inmunitarias del cerebro, suelen actuar como guardianes diligentes. Eliminan a los intrusos, como los microbios, y limpian los restos celulares, incluidas las placas típicas de la enfermedad de Alzheimer. Sin embargo, a medida que nuestro cerebro envejece, la microglía también cambia. Mientras que algunas siguen funcionando eficazmente, otras pierden gradualmente su función protectora y empiezan a segregar pequeñas cantidades de mensajeros inflamatorios.
Uno de estos mensajeros es la interleucina-12 (IL-12). Mediante meticulosos análisis, los equipos de investigación dirigidos por el Profesor Frank Heppner, Director del Departamento de Neuropatología de la Charité - Universitätsmedizin Berlin, y el Profesor Nikolaus Rajewsky, Director del Instituto de Biología de Sistemas Médicos de Berlín en el Centro Max Delbrück (MDC-BIMSB), junto con otros colaboradores, han identificado cómo la IL-12 podría desencadenar y acelerar la demencia de Alzheimer. Su estudio, publicado en "Nature Aging", podría allanar el camino para nuevas terapias combinadas.
"Durante décadas, la investigación del Alzheimer se ha centrado casi exclusivamente en los depósitos de beta-amiloide y tau, mientras que la inflamación se consideraba un efecto secundario", afirma Heppner. "Sólo recientemente hemos empezado a reconocer que los procesos inflamatorios pueden ser un motor primario de la progresión de la enfermedad". En 2012, el laboratorio de Heppner informó en Nature Medicine de que el bloqueo de la IL-12 y la IL-23 reducía significativamente los cambios cerebrales relacionados con el Alzheimer en ratones. "Pero no pudimos desentrañar el mecanismo subyacente con técnicas estándar", explica Heppner. Pensó que el análisis de células individuales podría aportar pistas más decisivas, así que pidió la colaboración de Rajewsky.
Células cerebrales pegajosas y enmarañadas
A lo largo de la vida, las células se remiten a sus instrucciones genéticas para responder a estímulos externos. Los investigadores utilizan análisis unicelulares para observar este proceso, reconstruyendo qué genes se leen y traducen en proteínas en miles de células individuales simultáneamente. Estos análisis generan conjuntos de datos masivos, que ahora pueden analizarse con ayuda de la inteligencia artificial y el aprendizaje automático. Sin embargo, uno de los principales retos de la tecnología de secuenciación unicelular es aislar células individuales de una muestra de tejido sin dañarlas ni provocar cambios no deseados. "En los cerebros de ratones que envejecen -especialmente los que tienen placas de Alzheimer- las células están tan pegadas y enredadas que separarlas limpiamente es casi imposible", explica Rajewsky.
Su equipo pasó varios años perfeccionando una solución. En lugar de aislar células enteras, extraen núcleos celulares del tejido cerebral y analizan el ARN presente en cada célula. Mediante referencias cruzadas con datos disponibles públicamente, como el Allen Brain Atlas, pueden garantizar que su método proporciona una instantánea representativa de todas las poblaciones celulares. Para el presente estudio, secuenciaron el ARN de más de 80.000 núcleos celulares y desarrollaron flujos de trabajo especializados para procesar los datos. También reconstruyeron la comunicación entre las células. "Nuestros equipos se reunieron varias veces para tratar de interpretar estos datos tan complejos", explica Rajewsky. "Esta minuciosa optimización inicial fue crucial: sin ella, no habríamos sido capaces de detectar estas conexiones".
Cómo daña la IL-12 el cerebro con Alzheimer
La IL-12, antes conocida sobre todo por su papel en enfermedades autoinmunes como la enfermedad de Crohn y la artritis reumatoide, parece desempeñar un papel fundamental en la progresión del Alzheimer. Daña dos tipos de células cerebrales clave: los oligodendrocitos maduros, que normalmente producen mielina -la capa grasa aislante que rodea las fibras nerviosas, esencial para la transmisión rápida de señales-, y las interneuronas, especialmente importantes para la cognición y la memoria. La unión de la IL-12 a las interneuronas provoca su muerte. Comienza así un círculo vicioso: A medida que más microglía produce IL-12, más células cerebrales sufren daños. Mientras tanto, las microglías funcionales restantes se ven sobrecargadas por la tarea de eliminar los restos celulares adicionales, por lo que no consiguen eliminar las placas de Alzheimer.
Para verificar este mecanismo, los investigadores lo probaron en ratones y en tejido humano. Cuando el equipo de Heppner bloqueó la IL-12 en cultivos celulares y modelos de ratón, pudieron frenar los cambios relacionados con la enfermedad. Las micrografías electrónicas de tejido cerebral de ratón tomadas en el Instituto Max Planck de Ciencias Multidisciplinares de Gotinga también mostraron cómo la estructura de la mielina y la densidad de las fibras nerviosas cambiaban dependiendo de si la vía de señalización de la IL-12 estaba presente o ausente. Los análisis de espectrometría de masas (lipidómica) de la Universidad de Zúrich confirmaron la alteración de la composición de la capa aislante rica en grasa. El estudio de tejidos de autopsias de enfermos de Alzheimer confirmó aún más los resultados: cuanto más avanzada estaba la enfermedad, mayor era la presencia de IL-12 en el tejido. Los cultivos celulares con oligodendrocitos humanos también fueron extremadamente sensibles a la IL-12.
Posible terapia combinada
"Ahora tenemos una imagen muy detallada de este mecanismo, en la que las tecnologías unicelulares han servido de catalizador crucial. La única pregunta que nos queda por responder es qué tipo celular afecta primero a la IL-12: los oligodendrocitos, las interneuronas o ambos simultáneamente", afirma Heppner, que también es Jefe de Grupo de Neuroinmunología en el Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE).
l estudio tiene implicaciones inmediatas, pues ya hay fármacos en el mercado que bloquean la IL-12. Los investigadores esperan que los médicos se basen en sus hallazgos e inicien ensayos clínicos. "Si estos fármacos resultan eficaces, serán una nueva flecha en la aljaba. El Alzheimer no tiene una sola causa. Uno de los ejes de la enfermedad también está controlado por el sistema inmunitario, al menos en algunos pacientes. Frenar la neurodegeneración requerirá una terapia combinada", subraya Heppner. Este enfoque podría comenzar en una fase temprana del proceso de la enfermedad, ya que la IL-12 puede medirse en sangre o líquido cefalorraquídeo, añade.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Shirin Schneeberger, Seung Joon Kim, Maria N. Geesdorf, Ekaterina Friebel, Pascale Eede, Marina Jendrach, Anastasiya Boltengagen, Caroline Braeuning, Torben Ruhwedel, ... Klaus-Armin Nave, Thorsten Hornemann, Burkhard Becher, Julia M. Edgar, Nikos Karaiskos, Christine Kocks, Nikolaus Rajewsky, Frank L. Heppner; "Interleukin-12 signaling drives Alzheimer’s disease pathology through disrupting neuronal and oligodendrocyte homeostasis"; Nature Aging, 2025-3-13