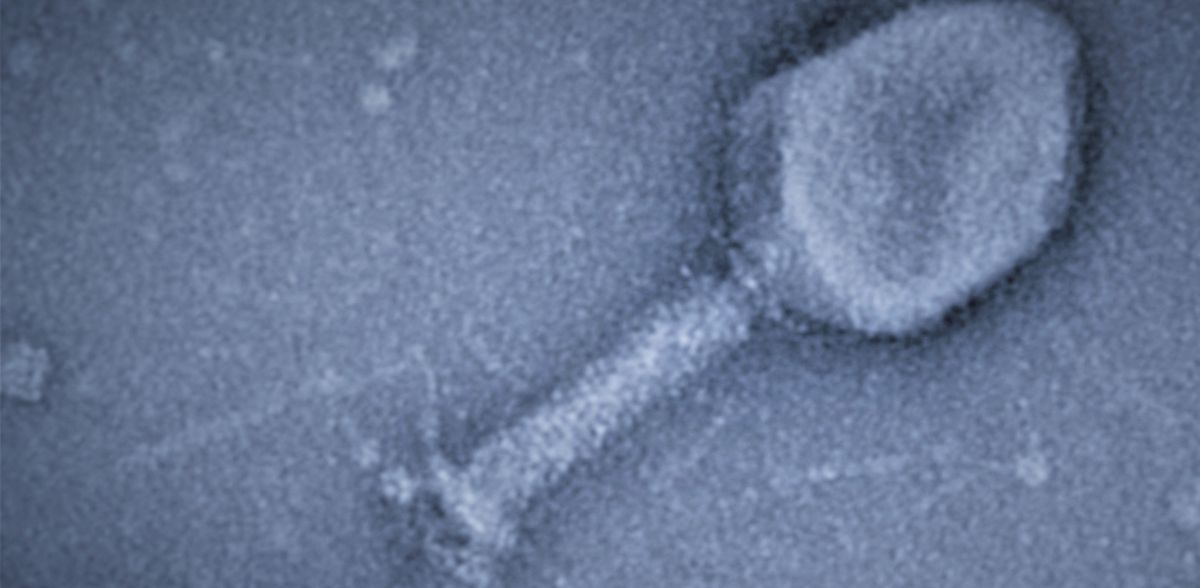
Los virus pegan el ARN a las proteínas
Hasta ahora se pensaba que el ARN y las proteínas sólo interactuaban brevemente durante los procesos celulares. Investigadores del Instituto Max Planck de Microbiología Terrestre de Marburgo (Alemania) han descubierto que no es así. Durante su ciclo de desarrollo, los virus bacterianos "pegan" ARN específicos a las proteínas del huésped. Como describen los autores en su publicación en la revista "Nature", la "ARNilación" podría abrir nuevas vías para la terapia con fagos o el desarrollo de fármacos.
"La vida es una relación entre moléculas", escribió el famoso biólogo Linus Pauling. Las interacciones entre proteínas y ARN (ácidos ribonucleicos) afectan a la traducción, la reparación de la información genética y el transporte de los bloques de construcción celular. Estas interacciones son contactos transitorios entre el ARN y las proteínas de unión al ARN basados en estructuras o secuencias específicas de ARN.
Ahora, un equipo de investigadores del Instituto Max Planck de Marburgo (Alemania) ha descubierto que las proteínas y el ARN también pueden estar estrechamente unidos entre sí en un denominado enlace covalente.
Los bacteriófagos como "asesinos rápidos"
En su estudio, publicado en el número actual de la revista Nature, el grupo de investigación dirigido por la Dra. Katharina Höfer examinó un sistema de bacterias y virus bacterianos (bacteriófagos). Estos últimos atacan a bacterias muy específicas, como el fago T4 que infecta a la bacteria E. coli. El T4 es un "asesino rápido": la célula bacteriana se destruye entre 20 y 30 minutos después de iniciarse la infección. Esto es más rápido de lo que actúa un antibiótico. Con el aumento de la resistencia a los antibióticos, se está estudiando la terapia con fagos como posible alternativa para tratar las infecciones bacterianas.
Para infectar a la bacteria, el bacteriófago T4 ha desarrollado estrategias fascinantes. Tras la invasión, utiliza tres ADP-ribosiltransferasas (ART) diferentes como biocatalizadores. Al unir una parte de la coenzima nicotinamida adenina dinucleótido (NAD) a las proteínas, estas ART modifican más de 30 proteínas del huésped. Esto permite al fago reprogramar y matar a la bacteria.
NAD-RNA conecta la investigación sobre ARN y fagos
Katharina Höfer lleva tiempo estudiando la función del ARN. Está especialmente interesada en los ARN-NAD, que son ARN portadores de un accesorio NAD. Hace ocho años, ella y sus colegas de la Universidad de Heidelberg descubrieron que este tipo de ARN se da en bacterias. Desde entonces, se han encontrado ARN con NAD en formas y tamaños muy diversos y en distintos grupos de organismos, pero su significado biológico seguía sin estar claro.
Katharina Höfer se preguntó si una ADP-ribosiltransferasa como la utilizada por el fago T4 podría unir no sólo NAD sino también NAD-ARN a proteínas. Para responder a esta pregunta, los investigadores tuvieron que desarrollar ellos mismos muchos métodos. Pero entonces quedó claro: la ART ModB del fago T4 no sólo acepta NAD, sino también NAD-ARN como sustrato, tanto en el tubo de ensayo como in vivo, en el sistema vivo. Los investigadores denominaron a esta novedosa reacción -la unión de un ARN completo a una proteína- ARNilación. Se trata de un concepto completamente nuevo de interacción natural ARN-proteína.
La ARNilación puede ser un mecanismo de control de los recursos celulares
Pero, ¿por qué el fago T4 utiliza la ARNilación? Al parecer, este proceso es esencial para una infección fágica eficaz, ya que los mutantes del fago T4 que carecen de ModB matan a las bacterias mucho más lentamente. El grupo de investigación pudo demostrar que, en células vivas, ModB une específicamente diferentes ARN a proteínas bacterianas implicadas en la traducción. Maik Wolfram-Schauerte, primer autor del estudio, sugiere: "La ARNilación puede ser parte de la estrategia del fago. La unión del ARN bacteriano a los ribosomas puede detener la traducción de las proteínas bacterianas, lo que permite al fago regular la biosíntesis de sus propias proteínas."
La ARNilación como nueva herramienta potencial para la biología sintética
Para investigar los mecanismos moleculares de la ARNilación, Katharina Höfer inició una colaboración con investigadores de la Universidad de Heidelberg y del Instituto Max Planck de Ciencias Multidisciplinares de Gotinga.
Katharina Höfer explica: "Nuestros resultados no sólo amplían la imagen anterior del ciclo de desarrollo de los fagos. Apuntan a una función biológica completamente nueva del ARN modificado con NAD, a saber, la activación del ARN para su transferencia enzimática a una proteína. Esto también abre nuevas vías de investigación".
Por ejemplo, la ARNilación podría convertirse en una herramienta para la biología sintética en el futuro. Como "pegamento molecular", podría utilizarse para formar conjugados específicos ARN-proteína con el fin de explotar las propiedades de las proteínas y los ácidos nucleicos en combinación.
Pero aún quedan muchas preguntas sin respuesta. "Algunos ART aceptan NAD-ARN, otros no, lo que plantea la cuestión del mecanismo exacto", explica Katharina Höfer. "La dificultad estriba en que la modificación es bastante amplia y compleja. En el tubo de ensayo, la ARNilación es relativamente fácil de detectar, pero in vivo, la diversidad de proteínas y ARN diana dificulta su estudio. Para dilucidar la función de la ARNilación, necesitamos desarrollar nuevos métodos para estudiar nuestras cuestiones específicas en el sistema vivo."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.