Electrones lentos para reacciones más eficaces
El nuevo método ayudará a mejorar el análisis de los daños por radiación y a optimizar determinadas reacciones químicas
Unos investigadores han conseguido producir electrones lentos en una solución. En el futuro, estos electrones podrían ayudar a hacer más eficientes ciertas reacciones químicas.
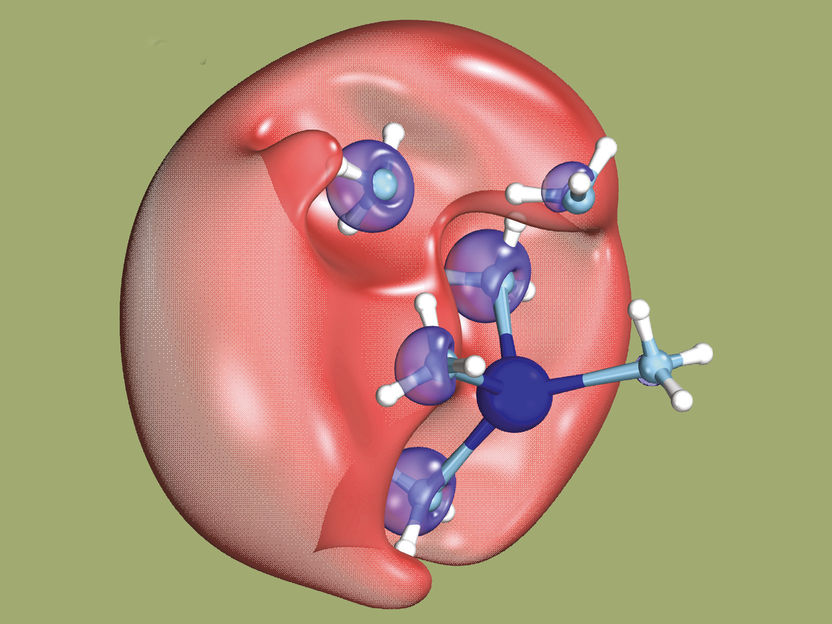
Aquí, dos electrones se unen brevemente en forma de dielectrón (rojo) rodeado de moléculas de disolvente. El dielectrón no puede localizarse con mayor precisión. Uno de los electrones abandonará posteriormente esta zona.
Hartweg S et al. Science 2023
Lo que el equipo internacional de investigadores se propuso en realidad fue detectar un misterioso objeto químico: un dielectrón en disolución. Un dielectrón está formado por dos electrones, pero a diferencia de un átomo, no tiene núcleo. Hasta ahora, los científicos habían sido incapaces de detectar directamente un objeto de este tipo. Mientras los investigadores dirigidos por Ruth Signorell, catedrática de la ETH de Zúrich, experimentaban con dielectrones, descubrieron accidentalmente un nuevo proceso para producir electrones lentos. Éstos pueden utilizarse para iniciar determinadas reacciones químicas.
Los dielectrones son inestables. Vuelven a separarse en dos electrones en menos de una trillonésima de segundo. Como pudieron demostrar los investigadores, uno de estos electrones permanece en su lugar, mientras que el otro -que tiene poca energía y es, por tanto, relativamente lento- se aleja. Lo especial del nuevo método es que permite a los investigadores controlar la energía cinética de este electrón y, por tanto, su velocidad.
Los dielectrones ocupan cavidades
Pero lo primero es lo primero: para producir los dielectrones, los investigadores disolvieron sodio en amoníaco (líquido) y expusieron esta solución a la luz ultravioleta. Esta exposición hace que un electrón de una molécula de amoníaco se una a un electrón de un átomo de sodio y forme así un dielectrón. El dielectrón ocupa brevemente una pequeña cavidad en la solución. Los investigadores consiguieron demostrar que cuando el dielectrón se rompe, uno de los electrones se aleja a una velocidad determinada por la longitud de onda de la luz UV utilizada. "Parte de la energía de la luz UV se ha transferido al electrón", afirma Signorell.
Los investigadores de la ETH de Zúrich llevaron a cabo este trabajo en colaboración con investigadores de la Universidad de Friburgo (Alemania), el sincrotrón SOLEIL (Francia) y la Universidad de Auburn (Estados Unidos).
Reacciones y daños por radiación
Los electrones de baja energía cinética son interesantes por varias razones. Una de ellas es que los electrones lentos provocan daños por radiación en los tejidos humanos. Los electrones móviles pueden formarse en estos tejidos, por ejemplo, como consecuencia de los rayos X o la radiactividad. A continuación, pueden adherirse a moléculas de ADN y desencadenar reacciones químicas. Producir estos electrones lentos más fácilmente en el laboratorio ayudará a los investigadores a examinar mejor los mecanismos que provocan daños por radiación.
Pero el cuerpo humano no es el único lugar donde las reacciones químicas son inducidas por un compuesto que acepta un electrón libre. La producción de cortisona sintética y otros esteroides es sólo un ejemplo.
Hacer posible el uso de la luz ultravioleta como medio relativamente sencillo de producir electrones lentos directamente en una solución, y además controlar la energía del electrón, facilitará un mejor examen de estas reacciones en el futuro. Los químicos podrían incluso optimizar las reacciones, por ejemplo utilizando la luz UV para aumentar la energía cinética de los electrones.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.




















































