Un nuevo método revoluciona el diagnóstico del cáncer
La innovadora tecnología "Deep Visual Proteomics" une cuatro tecnologías
¿Cómo surge el cáncer? ¿Cómo influye la composición celular en la malignidad del tumor? Estas preguntas son profundas y difíciles de responder, pero son cruciales para entender la enfermedad y encontrar la cura adecuada. Ahora, un equipo germano-danés dirigido por el profesor Matthias Mann ha desarrollado una tecnología innovadora denominada "proteómica visual profunda". Este método proporciona a los investigadores y a los médicos una lectura de proteínas para entender el cáncer con una resolución de un solo tipo de célula. La tecnología se ha publicado en la revista Nature Biotechnology y demuestra su potencial en una primera aplicación a las células cancerosas.
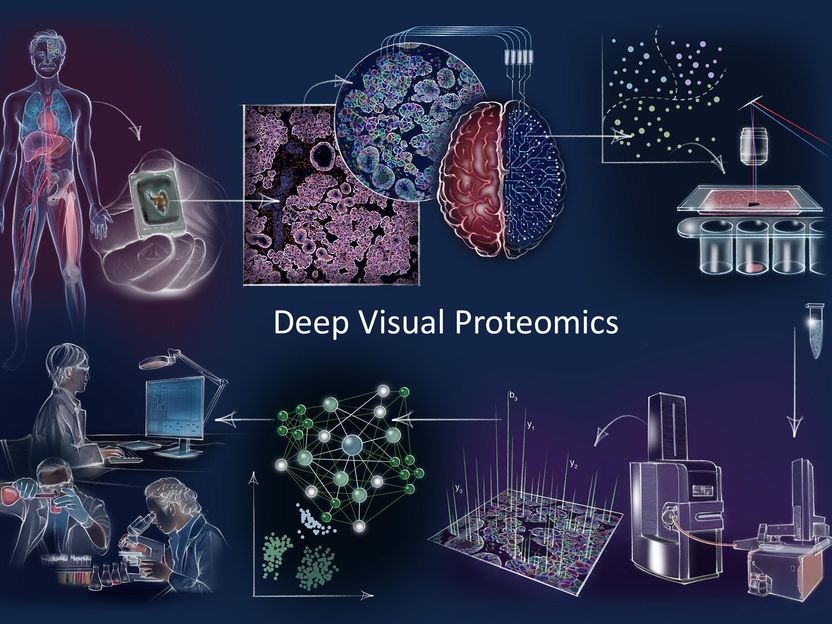
Concepto y flujo de trabajo de la proteómica visual profunda En el sentido de las agujas del reloj: La Proteómica Visual Profunda (DVP) combina la obtención de imágenes de alta resolución, el análisis de imágenes guiado por la inteligencia artificial (IA) para la clasificación y el aislamiento de células individuales con un novedoso flujo de trabajo de proteómica ultrasensible. La DVP vincula imágenes ricas en datos de cultivos celulares o tejidos de biobancos de pacientes archivados con la segmentación celular basada en el aprendizaje profundo y la identificación de tipos y estados celulares basada en el aprendizaje automático. Los objetos celulares o subcelulares de interés clasificados por la IA (no supervisados) se someten a una microdisección láser automatizada y a un perfil proteómico basado en la espectrometría de masas (EM). El posterior análisis de los datos bioinformáticos permite la extracción de datos para descubrir firmas de proteínas que proporcionan información molecular sobre la variación del proteoma en los estados de salud y enfermedad a nivel de células individuales.
© MPI of Biochemistry
Las proteínas se encuentran entre los actores más importantes de diversas enfermedades. Denominadas acertadamente "caballos de batalla moleculares de la célula", su correcto funcionamiento determina a menudo la aptitud de una célula y, por extensión, la de un individuo.
Matthias Mann lo explica: "Cuando algo va mal dentro de nuestras células y enfermamos, puede estar seguro de que las proteínas están implicadas de muy diversas maneras. Por eso, cartografiar el paisaje proteico puede ayudarnos a determinar por qué un tumor podría desarrollarse en un paciente concreto, qué vulnerabilidades tiene ese tumor y también qué estrategia de tratamiento podría resultar más beneficiosa".
Intrigado por estas cuestiones, un equipo de científicos multidisciplinares de los grupos de investigación dirigidos por Matthias Mann en el Instituto Max Planck (MPI) de Bioquímica, cerca de Múnich, y en el Centro de la Fundación Novo Nordisk para la Investigación de Proteínas (CPR) de la Universidad de Copenhague ha inventado un método innovador denominado "Proteómica Visual Profunda". El estudio combina las características visuales de un tumor con una tecnología de perfilado profundo para visualizar las firmas proteicas en las células aberrantes que son adyacentes a las células sanas circundantes. Esto proporcionaría a los investigadores una visión sin precedentes de la enfermedad y guiaría a los oncólogos para desarrollar estrategias inteligentes de diagnóstico y tratamiento.
La proteómica visual profunda une cuatro tecnologías
La proteómica visual profunda integra por primera vez los avances de cuatro tecnologías diferentes en un único flujo de trabajo: En primer lugar, la microscopía avanzada genera mapas de tejidos de alta resolución. En segundo lugar, se utilizan algoritmos de aprendizaje automático e inteligencia artificial (IA) para clasificar con precisión las células en función de su forma, tamaño o localización de proteínas antes de recoger las células individuales mediante una microdisección por captura láser de alta precisión. A continuación, tras clasificar las células normales o los distintos tipos de células enfermas, se detectan los miles de proteínas presentes en las poblaciones celulares de una sola vez mediante instrumentos de espectrometría de masas (EM) de altísima sensibilidad a partir de esta diminuta cantidad de muestra. Por último, sofisticados análisis bioinformáticos generan mapas de proteínas que proporcionan una resolución espacial de las firmas proteicas en enfermedades muy complejas como el cáncer. Estos paisajes de proteínas son herramientas valiosas para que los médicos comprendan con mayor detalle los mecanismos de la salud y la enfermedad.
"Nuestro nuevo concepto, 'Deep Visual Proteomics', podría convertirse en un cambio de juego para la patología molecular en los hospitales. Con este método, tomamos una muestra de tejido con células tumorales y podemos identificar y determinar miles de proteínas en un minuto de tiempo y esfuerzo. Estas firmas proteómicas revelan los mecanismos que impulsan el desarrollo de los tumores y exponen directamente nuevas dianas terapéuticas a partir de una sola porción de tejido de una biopsia de un paciente con cáncer. Expone un cosmos de moléculas dentro de estas células cancerosas", dice Andreas Mund, profesor asociado del CPR y parte del equipo del profesor Matthias Mann, que encabezó este desarrollo.
Relevancia para la patología clínica
En el nuevo estudio, los investigadores aplicaron la "Proteómica Visual Profunda" a células de pacientes con carcinoma de células acínicas y con melanoma. Lise Mette Rahbek Gjerdrum, consultora y profesora asociada de investigación clínica del Departamento de Patología del Hospital Universitario de Zelanda y del Departamento de Medicina Clínica de la Universidad de Copenhague, describe: "Este método único combina la arquitectura de los tejidos con la expresión de miles de proteínas específicas de las células seleccionadas. Permite a los investigadores estudiar las interacciones entre las células cancerosas y las que las rodean, con importantes implicaciones para el futuro tratamiento clínico del cáncer. Recientemente, hemos diagnosticado un caso clínico muy complejo utilizando la "Proteómica Visual Profunda"".
El Dr. Fabian Coscia, coprimer autor del estudio y -desde junio de 2021- jefe del grupo de investigación de "Proteómica Espacial" en el Centro Max Delbrück de Medicina Molecular de la Asociación Helmholtz (MDC) de Berlín, afirma: "Pero, por supuesto, la técnica puede utilizarse para caracterizar todos los demás tipos de tumores con detalles similares". Su objetivo, dice, es aprovechar los biobancos de pacientes archivados y encontrar nuevas dianas para las terapias contra el cáncer individualizadas, es decir, adaptadas al paciente, incluso para los tumores resistentes a los tratamientos anteriores.
Y no sólo se puede comprender mejor el cáncer mediante la "proteómica visual profunda". El método también puede aplicarse a otras enfermedades. "Por ejemplo, se pueden analizar las proteínas de las células nerviosas para saber exactamente lo que ocurre en ellas en enfermedades neurodegenerativas como el Alzheimer o el Parkinson", explica Fabian Coscia más adelante.
Al fusionar la potencia de la microscopía, la IA y la proteómica ultrasensible basada en la EM, hemos desarrollado un método muy potente para comprender el cableado molecular de las células sanas frente a las enfermas. Esto podría ayudar a los médicos a identificar objetivos para futuros medicamentos y diagnósticos", concluye Matthias Mann.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
A. Mund*#, F. Coscia*, A. Kriston, R. Hollandi, F. Kovács, A.-D. Brunner, E. Migh, L. Schweizer, A. Santos Delgado, M. Bzorek, S. Naimy, L.M. Rahbek Gjerdrum7,13, B. Dyring-Andersen, J. Bulkescher, C. Lukas, M.A. Eckert, E. Lengyel, C. Gnann, E. Lundberg, P. Horvath#, M. Mann#; * shared first-authors and # corresponding authors; Deep Visual Proteomics defines cell identity and heterogeneity; Nature Biotechnology, May 2022