Un estudio muestra cómo una sustancia bioactiva inhibe un importante receptor
Los resultados de la Universidad de Bonn abren la esperanza de nuevos fármacos contra el cáncer y las enfermedades cerebrales
El receptor A2A regula el vigor con el que el sistema inmunitario innato ataca a las células enfermas. Los investigadores de la Universidad de Bonn han podido demostrar por primera vez cómo se une al receptor un importante inhibidor. En el futuro, los resultados facilitarán la búsqueda selectiva de moléculas que den más fuerza al sistema inmunitario innato. Éstas podrían utilizarse, por ejemplo, en la lucha contra el cáncer, pero también contra enfermedades cerebrales como el Alzheimer o el Parkinson. La versión final del estudio se ha publicado en la revista Angewandte Chemie International Edition.
Pharmazeutische & Medizinische Chemie/Uni Bonn
Cualquiera que disfrute leyendo novelas de suspense lo sabe: antes de que los ladrones entren en una mansión, les gusta tirar por encima de la valla una jugosa chuleta en la que han escondido unos cuantos somníferos. Cuando los vigilantes se ponen a cenar por segunda vez, sucumben a un profundo sueño poco después. Las joyas de la señora de la casa cambian de manos mucho más imperturbables después de eso.
Las células tumorales suelen proceder de forma muy similar: Lanzan somníferos que paralizan el sistema inmunitario. Más concretamente, se rodean de una nube de adenosina, un importante mensajero endógeno. De este modo, desactivan las propias "células asesinas" del organismo, que de otro modo provocarían la muerte de las células cancerosas.
Esto se debe a que las moléculas de adenosina se unen a unas diminutas antenas en la superficie de las células inmunitarias, los receptores A2A (la abreviatura significa "receptores de adenosina tipo 2A"). De este modo, las tropas defensivas quedan fuera de combate, por así decirlo. Por ello, los investigadores de todo el mundo están buscando moléculas que puedan bloquear el receptor A2A y evitar el efecto paralizante de la adenosina.
Bombardeo con rayos X
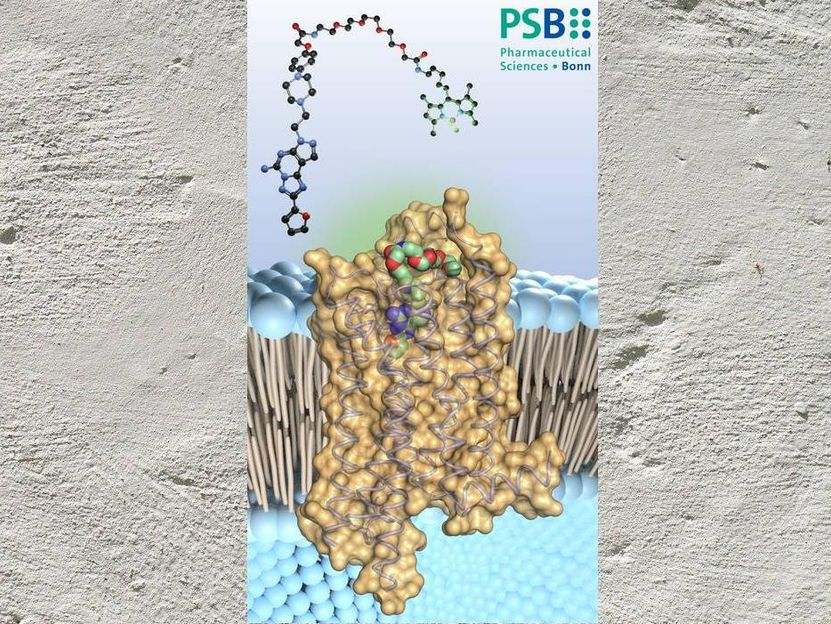
"Nuestro estudio debería facilitar mucho esta búsqueda", explica la Prof. Dra. Christa Müller, del Instituto Farmacéutico de la Universidad de Bonn. "Hemos añadido al receptor A2A nuevas variantes de un inhibidor conocido, una sustancia llamada preladenante. Luego creamos cristales de los complejos receptor-inhibidor; es la primera vez en el mundo que se consigue esto con sustancias similares al preladenante".
La cristalización permitió dilucidar la estructura del complejo. "Para ello, bombardeamos el compuesto con rayos X", explica Tobias Claff, que realizó la parte principal de los experimentos. "El cristal difracta los rayos. La forma en que lo hace nos permite deducir la estructura espacial del complejo, hasta la disposición de los átomos individuales y sus interacciones".
De este modo, los investigadores pudieron demostrar a qué puntos del receptor A2A se une el preladenante. Con este conocimiento, ahora es posible modificar específicamente el inhibidor para darle mejores propiedades. Además de tener un efecto lo más fuerte posible, los fármacos deben, por ejemplo, no descomponerse demasiado rápido. También deben poder llegar al lugar donde deben hacer su trabajo, en este caso, el cerebro. "Nuestro estudio facilitará la optimización de la sustancia", afirma Claff con optimismo.
El A2A pertenece a un grupo de receptores que regulan funciones clave en el organismo. Abarcan la membrana de las células. La parte de ellos que se sitúa en el exterior de la membrana sirve de sensor, recibiendo señales moleculares como una antena. Cuando lo hace, desencadena reacciones específicas con su parte que sobresale dentro de la célula. Así, por ejemplo, se activan determinados genes.
Tinte unido a la molécula inhibidora
"Estos receptores son inmensamente importantes debido a su posición central", dice Christa Müller, que también es miembro de las Áreas de Investigación Transdisciplinaria (TRA) "Bloques de Construcción de la Materia" y "Vida y Salud". "Muchos de ellos, sin embargo, son por desgracia relativamente inestables. Esto es desfavorable para los análisis estructurales con rayos X: la cristalización tarda días, a veces incluso semanas". Por ello, los investigadores modificaron específicamente el receptor A2A en un único punto, haciéndolo considerablemente más estable.
Además, consiguieron unir un colorante al precargante con una especie de cuerda molecular. "Esto nos permite controlar en qué parte del tejido se une el precargante al receptor A2A", afirma Müller. Al mismo tiempo, la longitud y la flexibilidad de la nanoserie garantizan que el inhibidor no se vea obstaculizado para unirse al receptor.
Ambos avances podrían servir de modelo para trabajar con otros receptores del mismo grupo. "Los métodos que hemos desarrollado en Bonn en los últimos años nos permitirán dilucidar la estructura de estas y otras proteínas de la membrana celular en el futuro", está convencido el farmacéutico. "No hay muchas instalaciones de investigación que puedan hacer este tipo de análisis estructural de moléculas extremadamente complejas".
Instituciones participantes y financiación:
Además de la Universidad de Bonn, participaron el Centro de Biología de Sistemas Estructurales (CSSB) y el Forschungszentrum Jülich. El estudio fue financiado por la Fundación Alemana de Investigación y el Ministerio Federal de Educación e Investigación.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Publikation: Tobias Claff, Dr. Tim A. Klapschinski, Dr. Udaya K. Tiruttani Subhramanyam, Victoria J. Vaaßen, Jonathan G. Schlegel, Christin Vielmuth, Jan H. Voß, Prof. Dr. Jörg Labahn and Prof. Dr. Christa E. Müller: Single Stabilizing Point Mutation Enables High-Resolution Co-Crystal Structures of the Adenosine A2A Receptor with Preladenant Conjugates, Angewandte Chemie International Edition.