La división celular errónea lleva a la muerte a las células cancerosas de los tumores infantiles
Los investigadores del cáncer han descubierto un mecanismo que puede activar la autodestrucción de las células cancerosas de los tumores infantiles
Una combinación de fármacos que ya se está probando en otros tipos de cáncer hizo que las células cancerosas acumularan errores en su material genético en ratones, lo que hizo que los tumores de huesos y tejidos blandos se redujeran en el laboratorio. Los científicos del Centro Oncológico Infantil Hopp de Heidelberg (KiTZ), el Hospital Universitario de Heidelberg (UKHD) y el Centro Alemán de Investigación del Cáncer (DKFZ) también demostraron que una molécula clave de la división celular podría utilizarse como nuevo biomarcador para seleccionar a los pacientes que se beneficiarían de esta terapia.
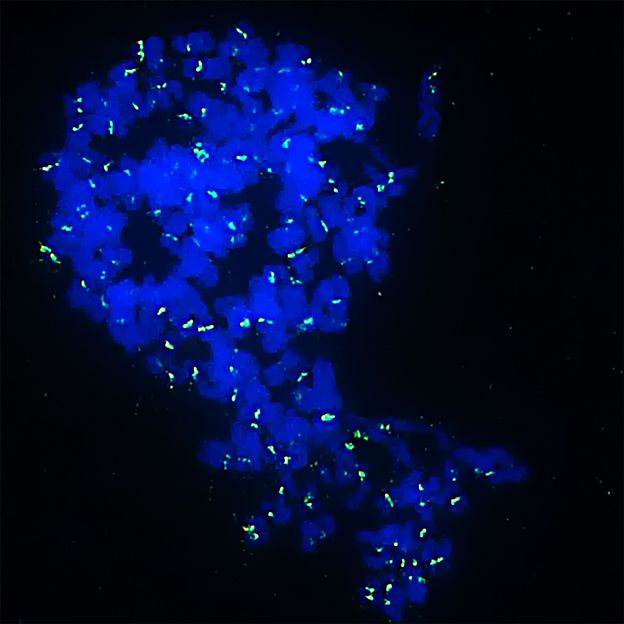
Los inhibidores hacen que las células del sarcoma de Ewing se conviertan en células monstruosas con múltiples juegos de cromosomas (en azul) y luego mueran. En verde se puede ver el sitio de los cromosomas que mantiene unidas las dos mitades de los cromosomas.
Jing Li/KiTZ
Normalmente, las células degeneradas genéticamente son conducidas al suicidio por un programa celular, lo que impide el desarrollo del cáncer mediante su muerte "voluntaria". Sin embargo, las células cancerosas consiguen escapar a la llamada muerte celular programada, también conocida como apoptosis, y continúan dividiéndose. Su material genético inestable les da incluso ventajas de crecimiento y las hace resistentes a la terapia.
En cambio, en algunos cánceres infantiles, como el sarcoma de Ewing, el genoma se comporta de forma notablemente tranquila y se encuentran pocos reordenamientos genómicos y cromosómicos de este tipo. Los sarcomas de Ewing son tumores muy agresivos que pueden formarse en los huesos o en los tejidos blandos y se dan principalmente en niños y adolescentes. "Muchas terapias estándar fracasan, especialmente en este tipo de cáncer, por lo que se necesitan urgentemente nuevas opciones de tratamiento", afirma Thomas Grünewald, jefe del Grupo de Investigación Traslacional de Sarcomas Pediátricos del KiTZ y del departamento del mismo nombre del DKFZ.
Junto con científicos de la Ludwig-Maximilians-Universität (LMU) de Múnich y el Consorcio Alemán para la Investigación Traslacional del Cáncer (DKTK), el equipo de Grünewald buscó una forma de aprovechar la estabilidad genética de las células cancerosas infantiles para conducirlas a la muerte. "Las células cancerosas infantiles siguen respondiendo a las señales de muerte celular programada. Por tanto, nuestra esperanza era que sólo teníamos que provocar el suficiente caos en el genoma de las células para que iniciaran su autodestrucción", explica Grünewald.
Los científicos ya habían apuntado a un punto débil molecular adecuado en trabajos anteriores: La proteína PRC1. "La PRC1 contribuye a la división estable de las células tumorales y se produce cada vez más por un gen canceroso mutado en el sarcoma de Ewing", explica el primer autor del estudio, Jing Li, que estudió intensamente la interacción molecular del gen mutado con la PRC1.
Combinando dos inhibidores que ya se están probando en ensayos clínicos contra otros tipos de cáncer, los científicos consiguieron interrumpir específicamente la actividad de PRC1 y, por tanto, la división celular de las células cancerosas. Las células cancerosas recién formadas acumularon más defectos hereditarios y formaron múltiples conjuntos de cromosomas, lo que les dio un aspecto extraño y dio lugar a células con núcleos enormes. Los tumores con estas "células monstruosas" se redujeron incluso si las células cancerosas se habían vuelto previamente resistentes a la terapia, demostró el estudio en ratones. La división celular anormal y la distribución desigual de los cromosomas hicieron que las células volvieran a poner en marcha su maquinaria de apoptosis. Sin embargo, esto sólo ocurría en los tumores con altos niveles de PRC1.
"En realidad, los resultados anteriores sugerían inicialmente que la combinación de fármacos utilizada aquí era poco prometedora en pacientes con sarcoma de Ewing", afirma Grünewald. "Los nuevos datos nos dan ahora la esperanza de que puede ser eficaz en pacientes con alta actividad de PRC1. Esto demuestra una vez más lo importante que es adaptar las terapias contra el cáncer al trasfondo molecular del tumor". "Los científicos quieren ahora comprobar si el nivel de PRC1 es adecuado como biomarcador fiable con más investigaciones y, si tiene éxito, desarrollarlo más en un ensayo clínico.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.