Ver la división celular en directo
La más alta resolución en el conocimiento de las células vivas
Las bacterias, como organismos unicelulares, se reproducen normalmente por división celular binaria, es decir, la duplicación de todo el organismo formado por una sola célula. Esto permite una multiplicación especialmente rápida, como el crecimiento exponencial conocido de los patógenos, y requiere la separación y distribución de dos copias idénticas del material genético bacteriano. Un factor importante en la división celular para una célula bacteriana en este proceso es la posición de su división, distribuyendo la información genética. Para muchas especies bacterianas, como la bacteria con forma de bastón Escherichia coli, este proceso ha sido bien investigado: aquí, un grupo de proteínas conocido como sistema Min actúa como unidad de control y asegura que las células se dividan exactamente en el centro. En la Universidad de Kiel, el grupo de Bioquímica Microbiana y Biología Celular dirigido por el profesor Marc Bramkamp trabaja, entre otras cosas, en los mecanismos de organización y reproducción de las bacterias, que utilizan para investigar los principios de aplicación general de la formación de patrones biológicos. Esta última tiene una importancia fundamental en biología, por ejemplo en el desarrollo de organismos multicelulares complejos.
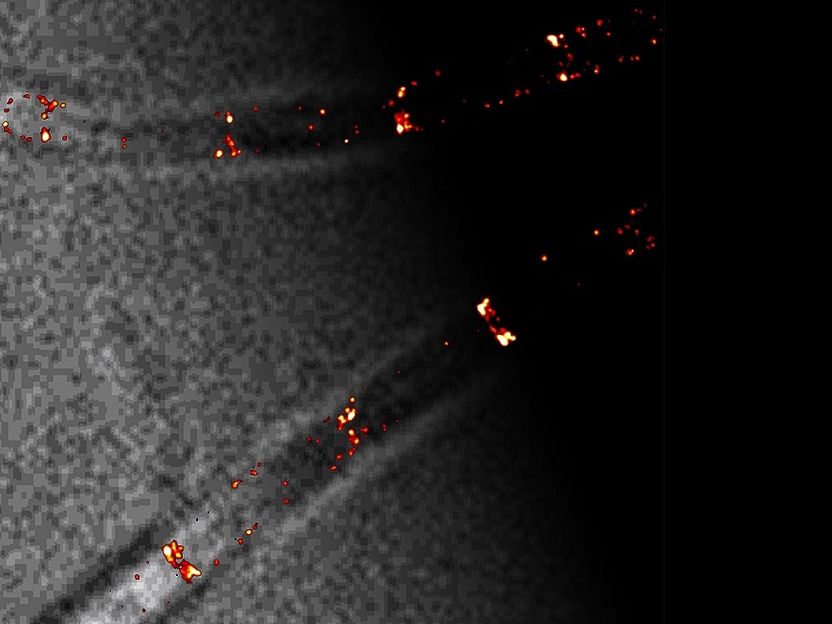
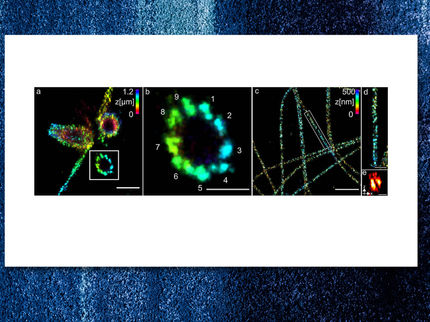
Ciertas proteínas del sistema Min marcadas con fluorescencia (en rojo) pueden verse en sus posiciones en una célula de B. subtilis. Las localizaciones de proteínas logradas por la microscopía de localización de una sola molécula son unas diez veces más precisas que la microscopía óptica convencional.
© Prof. Marc Bramkamp
En un nuevo trabajo de investigación, Bramkamp y su equipo del Instituto de Microbiología General de la Universidad de Kiel utilizaron la bacteria Bacillus subtilis como ejemplo para obtener nuevos conocimientos sobre cómo, como resultado de adaptaciones evolutivas, las proteínas del sistema Min pueden ajustar su función durante la división celular. Gracias a novedosas técnicas de imagen de alta resolución y a la aplicación de modelos matemáticos, pudieron demostrar que el sistema Min en B. subtilis no regula el posicionamiento de la división celular, sino que la detiene tras una división exitosa, a diferencia de lo que ocurre en muchas otras bacterias con forma de bastón. Los nuevos resultados fueron publicados por los investigadores de Kiel junto con colaboradores de la Universidad Ludwig-Maximilians (LMU) de Múnich en la revista científica mBio.
Diferentes dinámicas de las proteínas de la división celular
Para entender cómo actúan las proteínas del sistema Min en las células de B. subtilis , el equipo de investigación de Kiel optó inicialmente por un enfoque en dos fases. Los resultados de experimentos anteriores sugerían que las proteínas implicadas en la división celular no son estáticas, sino que se mueven dinámicamente en la célula dependiendo de su estado de actividad. Por ello, los investigadores las marcaron primero con una proteína fluorescente en el experimento. Utilizando un microscopio de fluorescencia especialmente equipado, pudieron entonces seguir los movimientos de las proteínas en la célula en tiempo real. "En E. coli se produce la llamada oscilación de las proteínas Min. En este proceso, su presencia se desplaza de un extremo a otro de la célula en pocos segundos. Por tanto, la distribución media es más baja en el centro exacto de la célula. Este es exactamente el lugar donde se forma el tabique, una pared divisoria de reciente formación, en E. coli", explica el Dr. Helge Feddersen, investigador asociado del grupo de Bramkamp. "En B. subtilis, sin embargo, no pudimos detectar tal oscilación con nuestras mediciones. Sin embargo, nuestras observaciones mostraron que las proteínas Min se mueven desde los polos de la célula hacia el centro justo después de que comience la división celular allí. Así pues, aunque la dinámica de las proteínas se mantiene en B. subtilis, el sistema no determina el lugar de la división", añadió Feddersen.
Para tener una idea precisa de la velocidad de las proteínas que se mueven en la célula, el equipo de Kiel aplicó un método de eliminación local de la etiqueta fluorescente en un segundo paso. Así, la fluorescencia se apagó de forma permanente, por ejemplo para las proteínas situadas en el tabique de división de la célula, mediante el blanqueo con un láser. Sin embargo, poco después se volvieron a encontrar proteínas fluorescentes en la misma posición, por lo que éstas sólo podían haber migrado hasta allí desde otro lugar de la célula. "A partir de esto, pudimos deducir con bastante precisión la velocidad a la que las proteínas Min se mueven en la célula en B. subtilis. Estos datos cuantitativos son muy importantes para construir un modelo matemático de la dinámica de Min", resume Feddersen el resultado más importante. Para confirmar los procesos observados en las células vivas, los investigadores de Kiel colaboraron con el grupo de investigación del profesor Erwin Frey de la LMU. En un modelo teórico, los socios de la cooperación de Múnich también pudieron confirmar teóricamente los patrones de movimiento del sistema Min - una señal importante de que todas las partes del sistema de proteínas esenciales para su función ya fueron identificadas en las observaciones.
La más alta resolución en células vivas
El hecho de que los nuevos conocimientos sobre la función desviada del sistema Min en B. subtilis sólo se hayan encontrado ahora se debe también a que la resolución de las imágenes era anteriormente insuficiente para tales observaciones. En la Universidad de Kiel se ha puesto a disposición recientemente la microscopía de localización de una sola molécula, una tecnología de alto rendimiento que proporciona la mejor resolución hasta ahora en células vivas. Esto permite localizar moléculas individuales, como las proteínas Min, en células vivas a escala nanométrica. A diferencia de los métodos estáticos, esto también permite seguir su dinámica, es decir, el movimiento de las proteínas individuales a lo largo del tiempo. "Sólo con nuestro microscopio de mayor resolución pudimos determinar en el siguiente paso que la agrupación se produce en las proteínas de la división celular de B. subtilis", subraya Bramkamp, jefe del grupo de Bioquímica Microbiana y Biología Celular. "Con la nueva tecnología de microscopía, la Universidad de Kiel está ahora excelentemente posicionada en la obtención de imágenes biológicas. En el marco de la instalación de Microscopía Central del Centro de Biología, también está a disposición de otros usuarios de diversas disciplinas de nuestra universidad", dice Bramkamp, que también es jefe científico de la instalación de imágenes.
"Esta técnica, que todavía se utiliza poco en biología, nos ha mostrado que un sistema proteico aparentemente bien conocido puede funcionar de forma muy diferente en la bacteria específica estudiada de lo que se suponía hasta ahora", continúa Bramkamp. Así, aunque los mismos sistemas proteicos están presentes en E. coli y B. subtilis, por ejemplo, realizan funciones completamente diferentes. "Sospechamos que el sistema Min en B . subtilis hace que se bloquee la división celular después de un paso exitoso, es decir, influye en el aparato de división celular activo y se asegura de que no siga funcionando después de una división exitosa", resume Bramkamp. La razón de esta adaptación puede ser que B. subtilis sigue una estrategia especial de supervivencia y -a diferencia de E. coli, por ejemplo- forma estados permanentes en forma de esporas que son resistentes a las influencias ambientales perjudiciales. Para que se formen estas esporas, la célula debe dividirse cerca del polo celular, es decir, en el lugar donde normalmente no debería producirse la división. Así, B. subtilis aparentemente logra este requisito modificando el sistema Min, permitiendo así esta forma sencilla de diferenciación celular durante la esporulación.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.