Cuando las proteínas trabajan juntas, pero viajan solas
Si una proteína puede realizar su función sólo cuando se ensambla en un complejo, ¿cuál es entonces el beneficio del desmontaje de un complejo?
Las proteínas, los "caballos de batalla" microscópicos que realizan todas las funciones esenciales para la vida, son jugadores de equipo: para hacer su trabajo, a menudo necesitan ensamblarse en estructuras precisas llamadas complejos de proteínas. Estos complejos, sin embargo, pueden ser dinámicos y de corta duración, con proteínas que se juntan pero que se disuelven poco después.

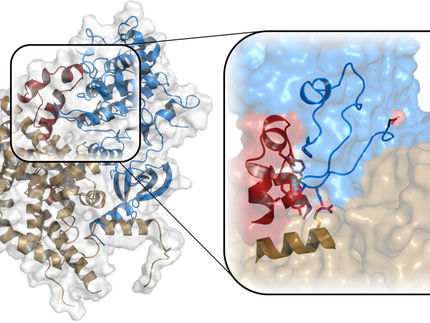
Como las piezas de un rompecabezas, las proteínas (amarillas) pueden encajar para formar un complejo. Sólo entonces son funcionales y capaces de unirse a las moléculas objetivo (rojo). Las proteínas se difunden más rápido como singletes y forman complejos cuando necesitan realizar su función.
© MPIDS / V. Novak, J. Agudo-Canalejo & R. Golestanian
En un nuevo artículo publicado en el PNAS, investigadores del Instituto Max Planck de Dinámica y Autoorganización, la Universidad de Oxford y la Universidad de la Sorbona muestran cómo el ensamblaje y el desensamblaje de los complejos de proteínas pueden operar en un "punto dulce" para beneficiar la función de las proteínas.
Si una proteína puede realizar su función sólo cuando se ensambla en un complejo, ¿cuál es entonces el beneficio de un desmontaje complejo? Esta es la pregunta clave que han abordado en este estudio Jaime Agudo-Canalejo, Pierre Illien y Ramin Golestanian. Los investigadores señalaron que, para realizar su función, las proteínas necesitan primero encontrar su objetivo a través del movimiento estocástico. Por ejemplo, en el caso de una enzima, que cataliza la conversión química de una molécula de sustrato en una molécula de producto, la enzima necesita primero encontrar el sustrato. "La observación clave es que las proteínas individuales, que componen el complejo, pueden moverse más rápido por sí solas que juntas como partes de un conjunto más voluminoso. Por lo tanto, el tiempo que se tarda en encontrar el objetivo puede ser más corto cuando se desmonta. Aún así, la función sólo puede realizarse si, una vez cerca del objetivo, las proteínas se reensamblan en el complejo requerido con la suficiente rapidez", dice Ramin Golestanian, director del Departamento de Física de la Materia Viva en MPIDS.
Los complejos proteicos siguen el principio de Ricitos de Oro
Para comprender la interacción entre estos dos efectos, los investigadores desarrollaron un modelo matemático que incorpora la difusión de la proteína, el ensamblaje y desensamblaje de los complejos y la reacción con un objetivo. Sorprendentemente, encontraron que hay un "punto dulce" en la concentración de proteínas. "Si hay muy pocas proteínas, estarán en su mayoría en el estado de desmontaje, y por lo tanto serán rápidas pero no funcionales. Si hay demasiadas, la mayoría estarán ensambladas en un complejo, y por lo tanto serán funcionales pero lentas. Sin embargo, para concentraciones intermedias en el punto dulce, los complejos de proteínas se desensamblan con suficiente frecuencia para moverse rápidamente, y se reensamblan con suficiente frecuencia para ser funcionales", explica Jaime Agudo-Canalejo, el primer autor del estudio. "La cantidad de proteína tiene que ser "justa", como en el principio de Ricitos de Oro", añade.
Sea dinámico pero manténgase en el lado seguro
El entorno dentro de las células está lejos de ser homogéneo, y ciertas moléculas pueden ser más o menos abundantes en diferentes regiones de la célula en un momento dado. En particular, las moléculas inhibidoras que promueven el desmontaje de los complejos de proteínas pueden concentrarse en una región determinada. En tal situación, ¿cuál es la distribución esperada de los complejos proteicos dentro de la célula? Utilizando su modelo matemático, los investigadores descubrieron que las proteínas tienden a acumularse espontáneamente en las regiones en las que su forma compleja es más estable, un fenómeno de desequilibrio que han denominado "estabilitaxis". Golestanian argumenta: "El estabilizador podría actuar como un mecanismo genérico que las células explotan para generar patrones espaciales en la distribución de las proteínas, en respuesta a los gradientes en la concentración de otra molécula". Agudo-Canalejo añade: "El mismo mecanismo podría emplearse en la ingeniería de materiales sintéticos que responden a estímulos externos, por ejemplo utilizando coloides recubiertos con ligantes activados por la luz". Por ello, los autores están especialmente entusiasmados con esta línea de investigación, que les permite tanto descubrir los intrincados mecanismos que se utilizan en la autoorganización en los sistemas biológicos como utilizarlos para proponer estrategias para aplicaciones de ingeniería.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.