Se identificó el componente faltante de la señalización inmunológica innata
El descubrimiento pone de relieve un nuevo objetivo potencial para el desarrollo de medicamentos para tratar ciertas enfermedades autoinmunes
La forma en que las células reconocen los patógenos y alertan rápidamente al sistema inmunológico es un proceso fundamental de gran importancia para la supervivencia de cualquier especie, incluidos los seres humanos. Se atribuye un papel fundamental a los denominados adaptadores, que equivalen a pequeñas plataformas moleculares en el interior de las células en las que las señales de los detectores de patógenos se integran para mayor seguridad y precisión y se transmiten a señales duraderas que conducen a la activación de los principales genes de "alarma roja", como los interferones.
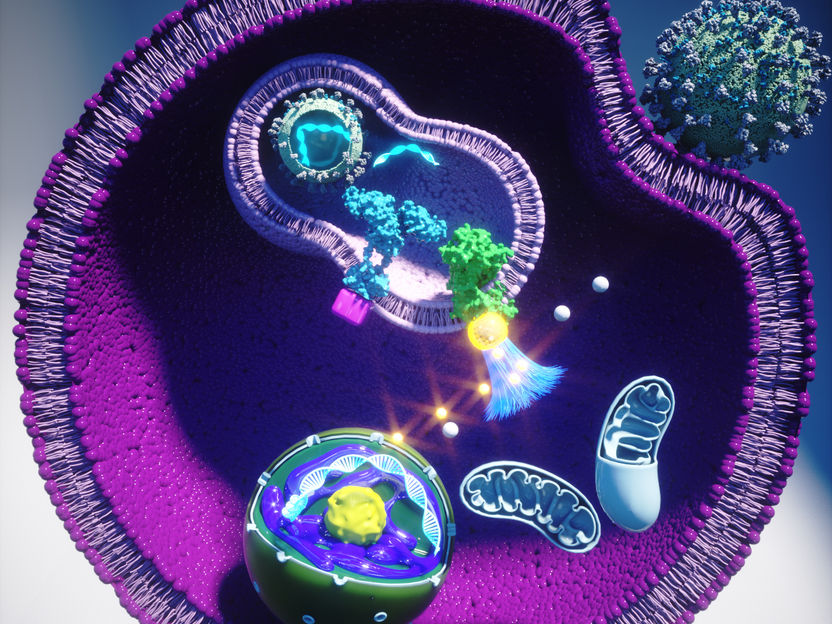
Resumen gráfico
Ella Maru Studio / CeMM
Los investigadores del laboratorio de Giulio Superti-Furga del Centro de Investigación de Medicina Molecular del CeMM de la Academia Austríaca de Ciencias, en colaboración con Boehringer Ingelheim, han identificado un nuevo elemento clave de la maquinaria multicomponente que es responsable de clasificar la naturaleza y la gravedad del desafío de los patógenos. La nueva proteína, denominada TASL, es indispensable para la señalización de los llamados receptores tipo Toll- (TLR) en los endosomas que conducen a la activación del activador genético IRF5 en ciertas células inmunes. La "puesta a punto" sensible de la maquinaria es muy importante, ya que demasiada producción causa inflamación también en ausencia del patógeno, como en las enfermedades autoinmunes. Esta versión particular de la maquinaria parece particularmente asociada con trastornos como el lupus eritematoso sistémico (LES). Este descubrimiento pone de relieve un nuevo objetivo potencial para el desarrollo de medicamentos para tratar ciertas enfermedades autoinmunes y posiblemente también una reacción excesiva a las infecciones virales y de otro tipo, y ha sido publicado en la revista científica Nature.
El sistema inmunológico es el sistema de defensa natural del cuerpo y está compuesto por una red de células, moléculas, tejidos y órganos que trabajan juntos para proteger el cuerpo contra agentes infecciosos, como virus, bacterias u hongos patógenos. El sistema inmunológico está equipado con un sofisticado repertorio de mecanismos de detección que detectan estos patógenos y orquestan una respuesta inmunológica adecuada. Las enfermedades autoinmunes se originan cuando el sistema inmunológico pierde la capacidad de diferenciarse de otros cuerpos extraños.
Estudios anteriores revelaron que el SLC15A4, un miembro de la mayor familia de proteínas transportadoras del cuerpo, se conocía como un componente esencial necesario para el correcto funcionamiento de estos TLR. Basándose en su gran interés en la investigación de la detección de patógenos por el sistema inmunológico innato y la caracterización de los portadores de solutos, los investigadores del grupo del Director Científico del CeMM, Giulio Superti-Furga, se propusieron investigar cómo influye el SLC15A4 en la capacidad de los TLR para detectar patógenos y, por consiguiente, comprender mejor su implicación en las condiciones autoinmunes y, en particular, en el LES.
En su estudio, el primer autor Leonhard Heinz y el equipo, incluidos los investigadores de Boehringer Ingelheim en Ridgefield, emprendieron un preciso trabajo de investigación, no dando por sentado los hallazgos anteriores sobre el SLC15A4 y la conexión con este grupo de TLRs especialmente localizados. Determinaron minuciosamente mediante bioquímica y espectrometría de masas las interacciones moleculares que implicaban al SLC15A4. Esto condujo a la identificación de una proteína no caracterizada CXorf21, perteneciente a los genes funcionalmente huérfanos que están meramente numerados y asignados al cromosoma de origen. El gen, como el SLC15A4, había sido previamente asociado vagamente con el LES.
El equipo demostró que la interacción entre el TASL y el SLC15A4 era crucial para la localización y la función de la proteína TASL y podía señalar las porciones precisas involucradas de ambas proteínas. Un momento eureka para la comprensión de la proteína llegó con la observación de que el TASL alberga un motivo específico esencial para el reclutamiento y la activación del IRF5. "Después de STING, MAVS y TRIF, la nueva proteína TASL es el cuarto adaptador de inmunidad innato clave que funciona como plataforma para el encuentro de una cinasa y un activador de genes de la familia del IRF", dice Manuele Rebsamen, investigador postdoctoral senior del CeMM y jefe de proyecto del estudio.
Estos hallazgos plantean la posibilidad de que la interferencia farmacológica con el complejo SLC15A4/TASL podría permitir la regulación de las respuestas de los TLR y, en consecuencia, modular las respuestas inflamatorias en el cuerpo. "Teníamos claro que el SLC15A4 desempeña un papel fundamental en la función endosómica del TLR y está implicado en la enfermedad, pero no se entendía el mecanismo subyacente. Estas son exactamente las apasionantes cuestiones científicas que nos encanta abordar en nuestro instituto", dice Giulio Superti-Furga, Director Científico del CeMM y responsable del estudio. Y añade: "Estamos contentos de que la visión que compartimos con Boehringer Ingelheim en cuanto a que los Portadores de Solute son un grupo de proteínas relevantes para la enfermedad dignos de ser investigados, haya sido recompensada en esta exitosa y excitante asociación".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.