El canal de iones VRAC mejora la respuesta inmune contra los virus
Nuevas estrategias contra los virus del ADN y el cáncer
Los canales de cloruro del VRAC/LRRC8 no sólo desempeñan un papel decisivo en el transporte de citostáticos, aminoácidos y neurotransmisores. También pueden transportar la importante sustancia mensajera cGAMP de una célula a otra y, de ese modo, fortalecer la respuesta inmunológica a las infecciones con virus del ADN. Esto ha sido demostrado ahora por el Prof. Thomas Jentsch, quien originalmente descubrió los canales del LRRC8/VRAC y trabaja en el Instituto de Investigación de Farmacología Molecular (FMP) de Leibniz y en el Centro Max Delbrück de Medicina Molecular (MDC) de Berlín, junto con colegas de Shanghai dirigidos por el Prof. Hui Xiao. Dado que el cGAMP siempre se forma cuando las células detectan ADN fuera de su núcleo, el descubrimiento es potencialmente de gran importancia también para otras patologías como el cáncer. El trabajo se ha publicado ahora en la revista científica "Immunity".
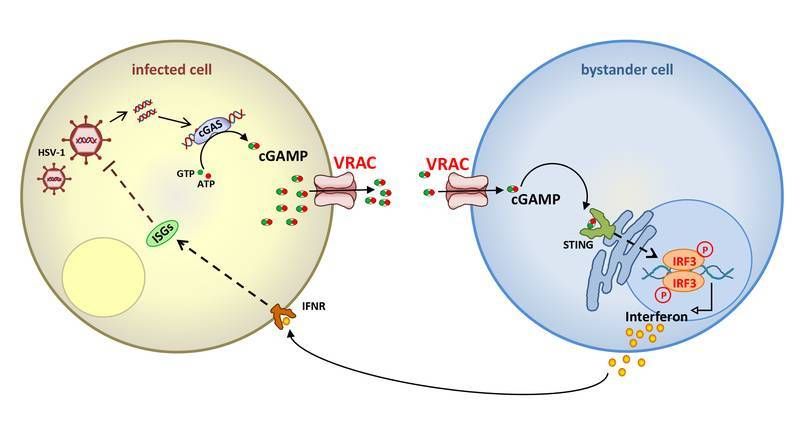
Tras la infección de las células con un virus de ADN (izquierda), el ADN viral se une a la enzima cGAS que luego sintetiza la molécula mensajera cGAMP. El presente trabajo muestra que el cGAMP puede salir de la célula a través del canal aniónico VRAC y se difunde a las células no infectadas de las proximidades. Después de entrar en la célula - de nuevo a través del VRAC - se une a un receptor llamado STING y estimula indirectamente la síntesis de interferón, que sale de la célula y suprime, después de unirse a un receptor, la propagación del virus (célula izquierda). Esto proporciona una poderosa amplificación de la respuesta inmune innata contra los virus de ADN.
Leibniz-Forschungsinstitut für Molekulare Pharmakologie im Forschungsverbund Berlin e.V. (FMP)
Si los virus de ADN como el herpes simple - el coronavirus, al ser un virus de ARN, no pertenece a este grupo! - infectan las células humanas; esto no pasa desapercibido. En el interior de la célula, el llamado citoplasma, el ADN no tiene lugar. Por lo tanto, si se detecta el ADN, se forman sustancias mensajeras que comienzan a dar la alarma. El ADN extraño se une a la enzima cGAS, que sintetiza el "segundo mensajero" cGAMP. Al unirse a un receptor llamado STING, cGAMP activa una cascada de señales celulares que desencadena la producción de interferones y otros factores del sistema inmunológico innato. Este mecanismo también se ha observado en células tumorales, en las que se liberan fragmentos de ADN desde el núcleo hasta el citoplasma, así como en algunas infecciones bacterianas.
El cGAMP es una sustancia mensajera altamente tópica
Las investigaciones sobre el cGAMP han explotado en los últimos años, en parte porque no sólo actúa en la célula donde se produce, sino que también pasa a otras células. Sin embargo, sigue sin estar claro cómo puede suceder esto. En las células que se ponen en contacto directamente entre sí, el cGAMP puede pasar a través de canales de conexión de células conocidos como "uniones de brecha". ¿Pero qué pasa con las células que no están en la vecindad inmediata?
Los investigadores dirigidos por el profesor Hui Xiao del Instituto Pasteur de Shanghai habían sospechado que las vías de transporte adicionales debían desempeñar un papel y se encontraron con el canal de aniones regulado por el volumen del VRAC, el canal de iones descubierto en 2014 por el profesor Thomas Jentsch y su equipo, y paralelamente por el profesor Zhaozhu Qiu (ahora Universidad Johns Hopkins), que también contribuyó a la publicación en "Immunity". Juntos, el equipo de investigación germano-chino fue capaz de demostrar con toda una variedad de métodos que el VRAC transporta el cGAMP tanto fuera de la célula productora como dentro de la célula receptora. Esto conduce a la producción de interferones en las células que no están infectadas, fortaleciendo así la respuesta inmunológica.
"Ahora sabemos que el VRAC definitivamente transporta cGAMP" dice Thomas Jentsch sobre este importante descubrimiento. "No conocíamos esta función todavía, pero encaja bien con nuestros hallazgos anteriores sobre el VRAC, a saber, que no sólo transporta cloruro, sino también otras pequeñas moléculas orgánicas, por ejemplo neurotransmisores, aminoácidos y citostáticos. La dependencia del transporte de cGAMP de la subunidad LRRC8E - VRAC está siempre compuesta de varias subunidades - que hemos observado ahora, concuerda bien con nuestros hallazgos anteriores, que mostraron que esta subunidad apoya el transporte de glutamato, que también está cargado negativamente".
La absorción de la sustancia mensajera por el VRAC se verificó mediante varios experimentos de cultivo celular y mediante enfoques electrofisiológicos. En un experimento, por ejemplo, las células fueron infectadas con un virus de ADN y separadas de las células sanas utilizando un filtro. La infección del virus no se pudo transmitir, pero también se observó una respuesta del interferón en las células no infectadas.
Por último, los experimentos con ratones knock-out generados en Berlín que carecían de la subunidad LRRC8E del VRAC proporcionaron pruebas convincentes: si los roedores estaban infectados con virus del herpes, se observó una carga viral mucho más alta y una menor liberación de interferón que en los animales de control no modificados. "Esto era exactamente lo que esperábamos, porque la sustancia mensajera ya no podía ser transferida de las células infectadas a las células vecinas debido a la ausencia del canal. Ya que esta transferencia normalmente fortalece la respuesta inmune", explica el profesor Jentsch. "La falta de transporte de cGAMP VRAC reduce en gran medida los mecanismos de defensa contra tales virus."
Nuevas estrategias contra los virus del ADN y el cáncer
El descubrimiento de este nuevo papel del VRAC en el sistema de defensa del cuerpo contra los virus de ADN, una nueva adición a las muchas funciones importantes del VRAC, atraerá aún más atención a este canal de iones. Los investigadores asumen que el VRAC podría jugar un papel similar en el cáncer. De hecho, otros han demostrado recientemente en experimentos con animales que el transporte de cGAMP desde las células cancerosas a las células huéspedes vecinas mejoró la respuesta inmune contra los tumores - pero cómo se transporta el cGAMP no estaba claro.
Además del VRAC y las uniones de brecha, un transportador de folato también transporta cGAMP a través de la membrana, como se demostró el año pasado. Sin embargo, el VRAC se encuentra en más tipos de células y por lo tanto probablemente juega un papel más importante. En el futuro, podría ser un enfoque viable para activar el VRAC para mejorar la respuesta inmunológica. Las posibles formas de hacerlo ya han sido descritas en el nuevo trabajo.
"El campo es increíblemente caliente", dice Thomas Jentsch, "y nuestro descubrimiento ofrece perspectivas completamente nuevas tanto para la investigación de infecciones como para la investigación del cáncer".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Zhou C. et al.; "Transfer of cGAMP into bystander cells by LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity"; Immunity; online 2020 April 10, in press.