Investigadores del CSIC revelan la estructura de una maquinaria clave en la división de las bacterias
Su elevada tasa de reproducción es una de sus principales armas para sobrevivir a los antibióticos
La elevada tasa de división de las bacterias, es decir, la exitosa forma en que se reproducen, es una de sus mejores armas contra los antibióticos. Un equipo del Consejo Superior de Investigaciones Científicas (CSIC) y la Universidad de Notre Dame (Estados Unidos) ha revelado la estructura de una maquinaria clave en ese proceso de división. Las conclusiones, publicadas en Nature Communications, abren la puerta al diseño de un futuro medicamento capaz de bloquear esta maquinaria tan precisa, sin la cual las bacterias se vuelven sensibles al efecto antibiótico.
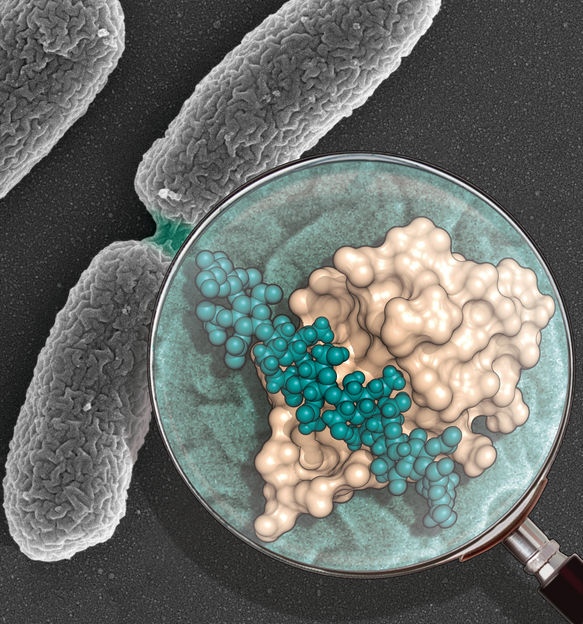
Dominio SPOR (en color beige) unido a la pared bacteriana (en esferas verdes). En el fondo se representa una imagen de microscopía de Pseudomonas aeruginosa dividiéndose en dos.
IFQR-CSIC
La división bacteriana está orquestada por un amplio conjunto de diversas proteínas que se ensamblan de manera ordenada y dinámica, formando una maquinaria precisa que garantiza el correcto devenir de la reproducción. Prácticamente todas las especies bacterianas poseen dominios especializados que reconocen la pared bacteriana (compuesta por peptidoglicano) en el momento de la división y posibilitan la correcta localización en el espacio y tiempo de estas proteínas durante la generación de las células hijas a partir de la célula madre.
Los científicos han empleado la cristalografía de rayos X para obtener la estructura de esos dominios especializados. En concreto, han estudiado el dominio SPOR (Sporulation-related repeat) de la proteína RlpA de Pseudomonas aeruginosa, una bacteria multiresistente para la cual existen muy pocos antibióticos disponibles, considerada por la Organización Mundial de la Salud como de “prioridad crítica”.
“Los dominios SPOR son usados por casi todas las bacterias durante el proceso de división. Sin embargo, a pesar de su relevancia, nadie había podido hasta ahora clarificar cómo funcionaban durante la división. Todas estas proteínas reconocen el mismo tipo de pared que se produce durante la división bacteriana. Nuestro trabajo revela, por primera vez, por qué todos los dominios SPOR reconocen el mismo tipo de pared para facilitar la división”, explica el investigador del CSIC Juan Antonio Hermoso, del Instituto de Química Física Rocasolano.
La investigación propone un modelo extrapolable a todo tipo de bacterias. “Nuestro resultados aportan información a nivel atómico de cómo los dominios SPOR se unen a la pared bacteriana y, por tanto, abren la puerta al desarrollo de moléculas que puedan bloquear específicamente estos dominios, lo que volvería a las bacterias sensibles a los antibióticos”, destaca Hermoso.
Publicación original
Martín Alcorlo, David A. Dik, Stefania De Benedetti, Kiran V. Mahasenan, Mijoon Lee, Teresa Domínguez-Gil, Dusan Hesek, Elena Lastochkin, Daniel López, Bill Boggess, Shahriar Mobashery y Juan A. Hermoso; "Structural basis of denuded glycan recognition by SPOR domains in bacterial cell division."; Nature Communications.
Noticias más leídas
Publicación original
Martín Alcorlo, David A. Dik, Stefania De Benedetti, Kiran V. Mahasenan, Mijoon Lee, Teresa Domínguez-Gil, Dusan Hesek, Elena Lastochkin, Daniel López, Bill Boggess, Shahriar Mobashery y Juan A. Hermoso; "Structural basis of denuded glycan recognition by SPOR domains in bacterial cell division."; Nature Communications.
Organizaciones
Más noticias del departamento ciencias

Reciba la industria de las ciencias biológicas en su bandeja de entrada
Al enviar el formulario, se muestra usted de acuerdo con que LUMITOS AG le envíe por correo electrónico el boletín o boletines seleccionados anteriormente. Sus datos no se facilitarán a terceros. El almacenamiento y el procesamiento de sus datos se realiza sobre la base de nuestra política de protección de datos. LUMITOS puede ponerse en contacto con usted por correo electrónico a efectos publicitarios o de investigación de mercado y opinión. Puede revocar en todo momento su consentimiento sin efecto retroactivo y sin necesidad de indicar los motivos informando por correo postal a LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlín (Alemania) o por correo electrónico a revoke@lumitos.com. Además, en cada correo electrónico se incluye un enlace para anular la suscripción al boletín informativo correspondiente.