Descifrado el mecanismo de acción de una proteína presente en bacterias patógenas “muy peligrosas”
Es la primera evidencia de que algunas bacterias que crecen en ausencia de oxígeno utilizan metabolismos hasta ahora exclusivos de los organismos fotosintéticos
Un equipo internacional liderado por una investigadora del Consejo Superior de Investigaciones Científicas (CSIC) ha estudiado una novedosa proteína que existe, de manera exclusiva, en algunas bacterias anaerobias, aquellas capaces de vivir en ambientes carentes de oxígeno. Los resultados del trabajo, que profundiza en las “propiedades únicas” de esta proteína presente en bacterias consideradas patógenos “muy peligrosos”, abre las puertas a la búsqueda de nuevas moléculas con actividad antibiótica.
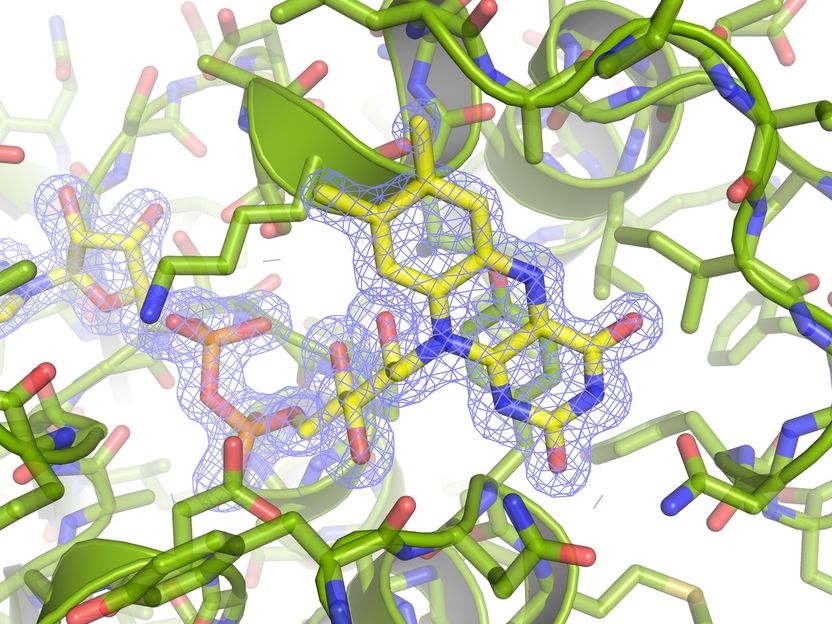
La proteína descrita, a resolución atómica. La densidad electrónica del cofactor de flavina (FAD) se muestra con una malla de color azul.
CSIC
Esta investigación supone la primera evidencia de que algunas bacterias que viven en ambientes que carecen de oxígeno, en los cuales no están tampoco expuestas a la luz, utilizan mecanismos metabólicos que hasta ahora se pensaba que eran exclusivos de los organismos fotosintéticos, como las algas y las plantas.
“Desde el punto de vista biomédico, el estudio presenta aún más relevancia si cabe, porque algunas de las bacterias en las que se encuentra esta proteína son patógenos extremadamente peligrosos, entre los que se incluyen Clostridium difficile, Clostridium botulinum y Clostridium tetani, causantes de la colitis pseudomembranosa, el botulismo y la enfermedad del tétanos, respectivamente”, detalla la investigadora del CSIC Mónica Balsera, que trabaja en el Instituto de Recursos Naturales y Agrobiología de Salamanca.
En concreto, la proteína estudiada es quimera de dos proteínas diferentes: la Tiorredoxina Reductasa dependiente de NADPH (NTR), que está presente en todos los organismos vivos conocidos, y la Tiorredoxina Reductasa dependiente de Ferredoxina (FTR), que es exclusiva de los organismos fotosintéticos. “La proteína resultante, denominada Flavín-Tiorredoxina Reductasa dependiente de Ferredoxina (FFTR), es especial porque contiene una mezcla inédita de las funcionalidades de las dos proteínas iniciales”, precisa Balsera, responsable de la investigación.
Publicación original
Más noticias del departamento ciencias

Reciba la industria de las ciencias biológicas en su bandeja de entrada
Al enviar el formulario, se muestra usted de acuerdo con que LUMITOS AG le envíe por correo electrónico el boletín o boletines seleccionados anteriormente. Sus datos no se facilitarán a terceros. El almacenamiento y el procesamiento de sus datos se realiza sobre la base de nuestra política de protección de datos. LUMITOS puede ponerse en contacto con usted por correo electrónico a efectos publicitarios o de investigación de mercado y opinión. Puede revocar en todo momento su consentimiento sin efecto retroactivo y sin necesidad de indicar los motivos informando por correo postal a LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlín (Alemania) o por correo electrónico a revoke@lumitos.com. Además, en cada correo electrónico se incluye un enlace para anular la suscripción al boletín informativo correspondiente.