Vielseitiger Schalter für lichtgesteuerte Zellen
Struktur der lichtgetriebenen Ionenpumpe KR2 liefert eine Blaupause für mögliche neue Werkzeuge der Optogenetik
Forschern aus Jülich, Frankfurt, Grenoble und Moskau ist es gelungen, die Struktur der lichtaktivierten bakteriellen Ionenpumpe KR2 zu entschlüsseln und sie anschließend mit einfachen Mitteln von einer Natrium- in eine Kaliumpumpe umzuwandeln. In Nervenzellen eingebaut, könnte KR2 damit zu wertvollen neuen Werkzeugen für die Optogenetik führen. Lichtempfindliche Proteine werden von dieser noch jungen Forschungsdisziplin als molekulare Schalter genutzt, um die Aktivität von Neuronen und anderen elektrisch erregbaren Zellen durch gezielte Lichtimpulse zu steuern. Die Ergebnisse wurden im Fachjournal Nature Structural and Molecular Biology veröffentlicht.
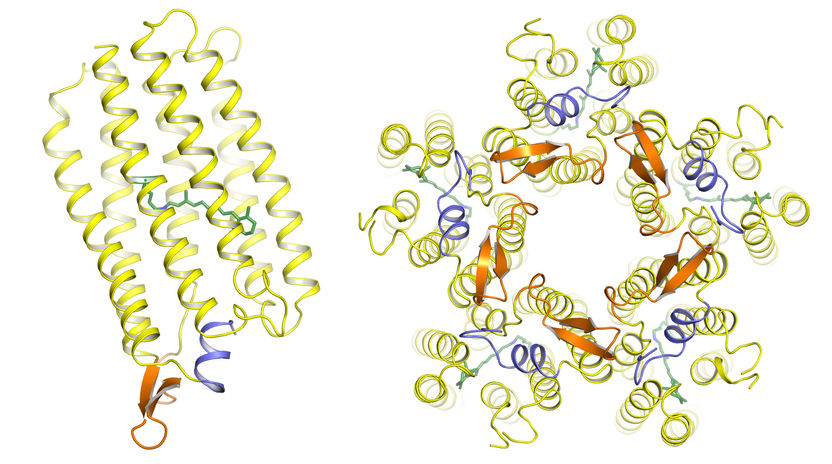
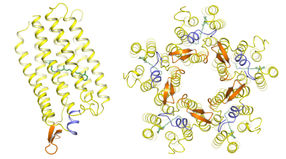
Links: Die KR2-Pumpe besteht, wie alle Proteine, aus einer einzigen langen Aminosäurekette, die sich zu einem komplexen Molekül faltet. Sieben spiralförmige Helices (gelb) bilden einen Kanal in der Zellmembran, durch den Natrium-Ionen transportiert werden. Anders als bisher bekannte lichtaktivierte Ionen-Pumpen besitzt KR2 eine zusätzliche achte Helix (blau), die wie ein Deckel über der nach außen zeigenden Öffnung liegt. Die Pumpaktivität wird durch das kleine lichtempfindliche Retinal (grün) gesteuert. Rechts: Unter physiologischen Bedingungen verbinden sich die KR2-Moleküle zu einem sternförmigen Komplex aus fünf Einzelproteinen.
Copyright: Forschungszentrum Jülich/IBS Grenoble
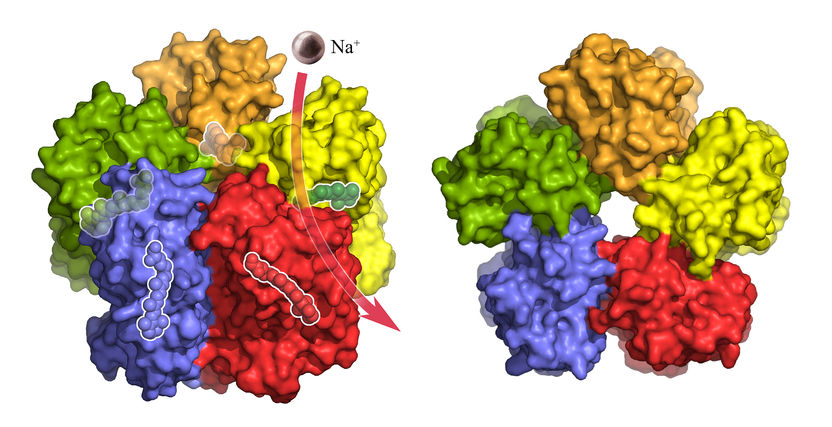
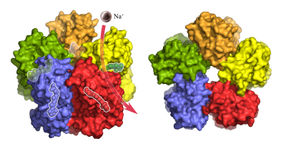
Der KR2-Komplex in der seitlichen Oberflächendarstellung. Jedes der fünf KR2-Moleküle in der Formation bindet und transportiert ein Natrium-Ion (lila). Transparent angedeutet ist das lichtempfindliche Retinal im Inneren, das die Pumpaktivität reguliert.
Copyright: Forschungszentrum Jülich/IBS Grenoble
Manchmal ist der Weg vom Meeresbakterium zum Instrument der Hirnforschung nicht lang: So etwa im Falle der molekularen Ionenpumpe KR2, die 2013 in der Zellwand des Bakteriums Krokinobacter eikastus entdeckt wurde. KR2 gehört zu einer Klasse von lichtempfindlichen Proteinen, die zur Basis des Forschungsgebietes der Optogenetik geworden sind. Bei Belichtung lassen sie geladene Teilchen in die Zelle strömen oder transportieren sie nach außen. Baut man diese Ionentransporter in die Membran von Nervenzellen ein, lässt sich deren Ladungszustand anschließend durch Lichtreize gezielt verändern, sodass ihre Aktivität präzise steuerbar wird. Besonders in den Neurowissenschaften hat sich das Verfahren in kürzester Zeit etabliert. Bislang stehen dafür allerdings nur wenige Proteine zur Verfügung, von denen jedes nur für bestimmte Ionen durchlässig ist.
Eine Pumpe wie KR2, die positiv geladene Natrium-Ionen aus der Zelle heraustransportiert, fehlt im Werkzeugkasten der Optogenetik bis jetzt. Allerdings waren bisher weder die genaue atomare Struktur noch der Mechanismus des Ionentransports bekannt. Um die Pumpe nutzbar zu machen und für gezielte Anwendungen anpassen zu können, wäre diese Kenntnis eine wichtige Voraussetzung. Dadurch weckte KR2 das Interesse von Strukturbiologen um Prof. Valentin Gordeliy, der Forschungsgruppen am Jülicher Institute of Complex Systems (ICS-6), am Institute de Biologie Structurale in Grenoble und am Moscow Institute of Physics and Technology leitet. Mit dem Verfahren der Röntgenkristallographie gewannen Gordeliy und sein Team hochaufgelöste Strukturbilder des Einzelproteins und des fünfteiligen Komplexes, zu dem sich KR2 Moleküle unter physiologischen Bedingungen von selbst zusammenfügen.
"Die Struktur weist Elemente auf, die man bisher von keiner anderen Ionenpumpe kennt", sagt Ivan Gushchin, einer der Erstautoren der Studie. Dazu gehört zum Beispiel eine Art Deckel in Form einer kurzen Proteinhelix, die direkt über der äußeren Öffnung der Pumpe liegt. Besonders interessierte die Forscher jedoch eine ungewöhnlich geformte Struktur im Inneren des Kanals entlang des Weges, den das Natriumion nehmen muss. "Wir vermuteten darin eine Art Filterelement, das vielleicht für die Natrium-Selektivität von KR2 verantwortlich sein könnte", erklärt Gushchin.
Um diese Idee zu testen, veränderten Gordeliy und sein Team die Struktur an der fraglichen Stelle durch den gezielten Austausch einzelner Aminosäuren. Nicht nur verlor KR2 dabei tatsächlich seine Fähigkeit zum Natriumionen-Transport. Bei einer der Mutationen schien sich KR2 von einer Natrium- in eine Kalium-Pumpe umzuwandeln. In gemeinsamen Experimenten mit Ernst Bamberg am Max-Planck-Institut für Biophysik in Frankfurt am Main, einem Experten für Membranproteine, der zu den Begründern der Optogenetik zählt, konnte dieses Ergebnis auf Grund elektrophysiologischer Untersuchungen am gereinigten Protein bestätigt werden.
Für die Optogenetik könnte dieses Resultat ganz besonders interessant werden, erklärt Ernst Bamberg: "Bei Neuronen ist der Transport von Kalium-Ionen aus der Zelle gewissermaßen der natürliche Mechanismus für die Deaktivierung. Aktivierte Neuronen werden in den Ruhezustand zurückversetzt, wenn Kalium-Ionen aus der Zelle strömen. Normalerweise geschieht das über passive Kanäle, durch die sich die Ionen von selbst entlang des Konzentrationsgefälles bewegen. Mit einer durch Licht aktivierbaren nach außen gerichteten Kalium-Pumpe ließe sich der Vorgang dagegen auf viel gezieltere Weise steuern." KR2 könnte damit zu einem effektiven Aus-Schalter für Nervenzellen werden. Zunächst müssten nun allerdings Wege gefunden werden, die Pumpe in verschiedene Zelltypen einzubauen. "Zusammen mit Channelrhodopsin 2, einem lichtgesteuerten Kationenkanal, der heute bereits weltweit in vielen Labors für die Aktivierung von Neuronen eingesetzt wird, würde die Kaliumpumpe dann ein ideales Paar bilden, um Nervenzellen präzise an- und abzuschalten", so der Forscher.