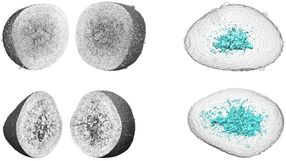
Ein Lichtsensor im Kopf: Forscher entwickeln neuartigen Schalter fürs Gehirn
Wie lernen Menschen? Warum werden wir süchtig? Lässt sich ein epileptischer Anfall einfach abschalten? Fragen wie diese lassen sich künftig eventuell besser erforschen: Wissenschaftler des Universitätsklinikums Hamburg-Eppendorf (UKE) und der Humboldt-Universität zu Berlin haben einen neuartigen molekularen Schalter geschaffen, der wichtige Impulse für die Hirnforschung liefern könnte. Ihre aktuellen Erkenntnisse haben Prof. Dr. Thomas Oertner, Prof. Dr. Peter Hegemann und ihre Mitarbeiter in „Science“ veröffentlicht.
„Wir haben die Leitfähigkeit umgedreht und aus einem aktivierenden ein hemmendes Protein gemacht“, erklärt Prof. Dr. Thomas Oertner, Direktor des Instituts für Synaptische Physiologie am Zentrum für molekulare Neurobiologie Hamburg (ZMNH). „Das ist für die Molekularbiologie außergewöhnlich. Bislang war unbekannt, dass es möglich ist, durch eine Punktmutation – die Veränderung eines einzelnen Buchstabens im genetischen Code – ein solches Kanalprotein umzupolen.“ Hinzu komme: „Wir konnten zeigen, dass man mithilfe dieses Verfahrens Nervenzellen gezielt abschalten kann.“ Für die Grundlagenforschung öffnen sich dadurch völlig neue Möglichkeiten: Thomas Oertner und sein Team wollen beispielsweise emotionale Aspekte des Lernverhaltens untersuchen. Denkbar ist für den Experten, auf der Grundlage dieses Verfahrens einen „Not-Aus-Schalter“ für Menschen mit einer schweren Epilepsie zu entwickeln. Dieser könnte bei einem Anfall die Aktivität des betreffenden Hirnareals dämpfen.
Von der Alge zur Hirnforschung – das neue Forschungsfeld Optogenetik
Sogenannte Kanalrhodopsine (auch: Channelrhodopsine) sind lichtabhängige Proteine, die Poren für elektrisch geladene Ionen innerhalb von biologischen Membranen bilden. Werden diese Poren geöffnet oder geschlossen, ändert sich die elektrische Spannung an der Membran. Nervenzellen können auf diese Weise mithilfe von Lichtreizen angeregt oder blockiert werden. Entdeckt wurden Kanalrhodopsine in einzelligen Grünalgen, die mit Ihrer Hilfe auf Licht reagieren. Der Berliner Molekularbiologe Prof. Dr. Peter Hegemann gilt als ihr Entdecker. Er hat durch seine Arbeiten zudem das neue Forschungsfeld der Optogenetik begründet. Dank der Erkenntnisse der UKE-Wissenschaftler um Thomas Oertner, die in enger Zusammenarbeit mit dem Team von Peter Hegemann entstanden sind, haben Optogenetiker nun völlig neue molekulare Werkzeuge zur Verfügung: So öffnet eines der neuen Proteine – das „Chloridleitende Channelrhodopsin mit lang anhaltender Aktivität“, kurz: slow ChloC – seine Pore auf einen kurzen Lichtreiz hin sehr viel länger als die bisher zur Verfügung stehenden lichtgesteuerten Proteine. „Das bedeutet, wir benötigen jetzt zehntausend Mal weniger Licht, um Nervenzellen gezielt abschalten zu können“, erklärt Thomas Oertner.
Originalveröffentlichung
Wietek J, Wiegert JS, Adeishvili N, Schneider F, Watanabe H, Tsunoda SP, Vogt A, Elstner M, Oertner TG, Hegemann P (2014). Conversion of Channelrhodopsin into a light-gated chloride channel. Science, March 27, 2014.
Meistgelesene News
Originalveröffentlichung
Wietek J, Wiegert JS, Adeishvili N, Schneider F, Watanabe H, Tsunoda SP, Vogt A, Elstner M, Oertner TG, Hegemann P (2014). Conversion of Channelrhodopsin into a light-gated chloride channel. Science, March 27, 2014.
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.