Bakterien-Gift stellt Weichen auf Infektion
Wissenschaftler klären Rolle eines Erreger-Moleküls auf
Für mehr als fünf Millionen Menschen haben Magen-Darm-Erkrankungen jedes Jahr tödliche Folgen. Braunschweiger Forscher haben jetzt herausgefunden, was einen Stamm von Yersinia pseudotuberculosis – einer der Hauptverursacher dieser Infektionen – so gefährlich macht: Die Bakterien produzieren ein Molekül namens CNFy, das ihnen die Infektion erleichtert. Es verändert die Wirtszellen in einer Weise, dass der Injektionsapparat von Yersinia, der Giftstoffe in die Zellen spritzt, effektiver arbeiten kann. Dies verstärkt die Infektion und führt zu Entzündungen des Gewebes.
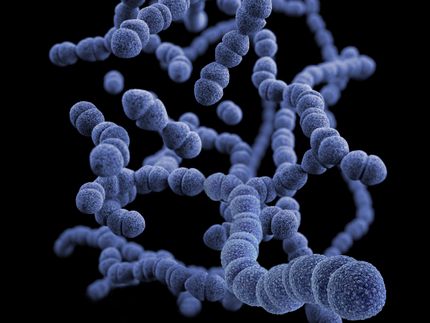
Yersinien (in blau) verursachen schwerwiegende Infektionen.
HZI/Manfred Rohde
Ob eine Immunzelle sich teilt, andere Immunzellen alarmiert oder stirbt – Prozesse wie diese werden in unserem Immunsystem streng kontrolliert. Einfluss auf ihren Ablauf haben „molekulare Schalter“, die gewissermaßen die Weichen für die unterschiedlichen Wege stellen. Angesichts des evolutionären Wettstreits zwischen dem Immunsystem und den Mikroben sind Wissenschaftler nicht überrascht, dass Bakterien Substanzen entwickelt haben, um die Weichenstellung zu ihrem Vorteil zu beeinflussen.
Eine solche Substanz haben Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) in Braunschweig und der Medizinischen Hochschule Hannover (MHH) genauer untersucht. Ihre Ergebnisse veröffentlichten sie in der amerikanischen Fachzeitschrift PLOS Pathogens. Das Team um Prof. Petra Dersch, Leiterin der Abteilung Molekulare Infektionsbiologie am HZI, wurde auf das Molekül namens CNFy aufmerksam, weil das Bakterium Yersinia pseudotuberculosis es in großen Mengen produziert.
Yersinia pseudotuberculosis wird über verunreinigte Lebensmittel übertragen und kann Magen-Darm-Erkrankungen hervorrufen. Allerdings verfügen nicht alle Stämme über CNFy. Daher nahmen Wissenschaftler bislang an, es spiele keine große Rolle. Dass dies ein Irrtum ist, hat das interdisziplinäre Team nun gezeigt. „Bakterien stellen nur Moleküle her, die ihnen nutzen. Daher hat uns interessiert, wozu Yersinia CNFy benötigt“, sagt Dersch.
Um das herauszufinden, haben die Wissenschaftler einen Stamm, der normalerweise CNFy bildet, genetisch so verändert, dass er das Molekül nicht mehr produzieren kann. „Das veränderte Bakterium war nicht mehr in der Lage, dem Immunsystem des Wirtsorganismus zu entkommen und konnte keine Krankheit hervorrufen“, berichtet Janina Schweer, Doktorandin am HZI. Das ist erstaunlich, denn die Bakterien haben durchaus weitere krankmachende Eigenschaften in ihrem Repertoire: Sie verfügen über große Molekülkomplexe, mit denen sie – ähnlich wie mit einer Spritze – krankheitsfördernde Substanzen in die Wirtszelle transportieren. Normalerweise ein sehr effektives Mittel, um eine Infektion voranzutreiben. „Es scheint, als sei dieser Mechanismus in einigen Yersinien nicht ausreichend aktiv. Offenbar braucht der untersuchte Yersinien-Stamm CNFy, damit seine „molekularen Spritzen“ genug Wirkstoffe in Immunzellen injizieren können“, erklärt Prof. Jochen Hühn, Leiter der Abteilung Experimentelle Immunologie am HZI. Diese Wirkstoffe, oft Gifte, schaden den Immunzellen. Viele der Substanzen lösen den Tod der Zelle aus. Das erleichtert Yersinia die Ausbreitung im infizierten Organismus. Bei fortgeschrittener Infektion kommt es zudem zu Entzündungen und einer Schädigung des Gewebes.
Die Forscher haben auch den „molekularen Schalter“ identifiziert, den CNFy umlegt, um die dramatischen Folgen hervorzurufen: Es handelt sich um die sogenannten kleinen Rho GTPasen. Diese Enzyme setzen ganze Kaskaden von Ereignissen in Gang, beispielsweise Veränderungen des Zellskeletts. Dadurch entstehen Poren in der Zelloberfläche, durch die bakteriellen Spritzen leichter Wirkstoffe in die Zelle transportieren können. Auch der beobachtete Zelltod der Immunzellen wird durch Rho GTPasen eingeleitet.
„Wir haben hier einen cleveren Schachzug von Yersinia pseudotuberculosis aufgedeckt. Mit CNFy braucht das Bakterium nur ein einzelnes Protein, das die Zelle so aktiviert, dass der Injektionsapparat effektiver arbeiten kann“, erklärt Dersch. „Es stellt die Weichen auf Infektion.“
Die aktuelle Studie zeigt, dass CNFy für Yersinia sehr wichtig ist. Gleichzeitig unterstreicht sie die zentrale Rolle des Injektionsapparates, der durch CNFy verstärkt zum Einsatz kommt – er ist und bleibt ein wichtiges therapeutisches Angriffsziel, um die Infektion einzudämmen.
Originalveröffentlichung
Janina Schweer et al.; The cytotoxic necrotizing factor of Yersinia pseudotuberculosis (CNFy) enhances inflammation and Yop delivery during infection by activation of Rho GTPases. PLOS Pathogens, 2013