Wachstum von Blutgefäßen wird von G-Protein kontrolliert
Wichtiger Baustein des Zusammenspiels von Gefäßwachstumsfaktoren und ihrer Rezeptoren entdeckt
Die Bildung neuer Blutgefäße spielt in allen Phasen des Lebens eine wichtige Rolle für den Organismus. Forscher des Max-Planck-Instituts für Herz- und Lungenforschung in Bad Nauheim haben nun neue wichtige Bausteine des Mechanismus identifiziert, über den das Blutgefäßwachstum reguliert wird. Die Wissenschaftler hoffen deshalb, neue Ansatzpunkte zur Behandlung von Tumorerkrankungen entdeckt zu haben.
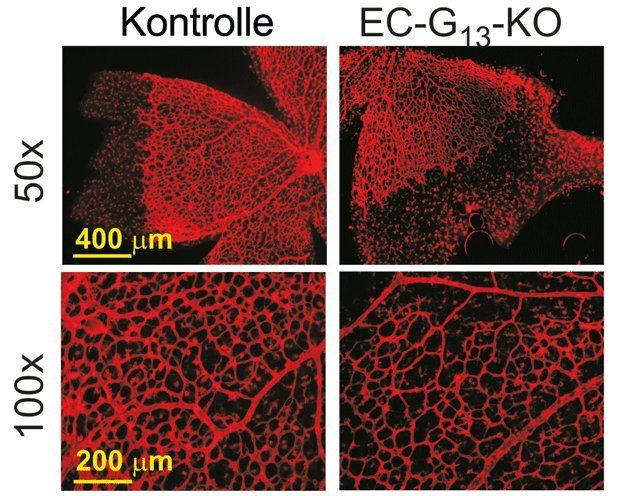
Ohne G13 weniger Wachstum von Blutgefäßen. Die Abbildung zeigt Gefäße in der Netzhaut von sechs Tage alten Mäusen, links von Kontrolltieren, rechts von Tieren nach gentechnischem Ausschalten von G13 in Gefäßzellen. Bei letzteren werden die Blutgefäße zunächst normal gebildet, nach Ausschalten des Rezeptors wachsen die Gefäße aber deutlich langsamer. Dadurch wird das Gefäßnetz weitmaschiger.
© Max-Planck-Institut für Herz- und Lungenforschung
Zeit seines Lebens bilden sich im Organismus immer wieder neue Blutgefäße. Bereits im frühen Embryo entsteht ein zunächst primitives Blutgefäßsystem, das mit der fortschreitenden Entwicklung der Organe zunehmend komplexer wird. Viele Gewebe entwickeln sich erst nach der Geburt zu Ende. So dauert es rund eine Woche, bis die Netzhaut im Auge vollständig mit Blutgefäßen versorgt ist. Auch beim Erwachsenen bilden sich ständig neue Gefäße. Neben diesem „normalen“ physiologischen Wachstum spielt die Gefäßbildung bei einer Reihe von Erkrankungen eine wichtige Rolle. Tumoren beispielsweise stimulieren das Wachstum neuer Blutgefäße und stellen so die eigene Nährstoffversorgung sicher.
Deshalb ist es nicht verwunderlich, dass das Wachstum neuer Blutgefäße, auch als Angiogenese bezeichnet, ein gut untersuchtes Forschungsfeld ist. Zwei Hauptakteure sind schon lange bekannt, die das Auswachsen der Innersten Gefäßschicht, des Endothels, regulieren. Dabei handelt es sich um einen Wachstumsfaktor mit dem Namen VEGF und sowie den VEGF- Rezeptor als passendes Gegenstück. Von letzterem existieren mehrere Subtypen, von denen vor allem der VEGFR-2 im Vordergrund steht.
In Geweben mit aktivem Blutgefäßwachstum lassen sich hohe Konzentrationen von VEGF und VEGFR-2 nachweisen. Bereits vor rund fünfzehn Jahren gab es Hinweise darauf, dass einem G-Protein, dem G13, eine Schlüsselposition bei der Regulation der Angiogenese zukommt. Nina Wettschureck aus der Abteilung Pharmakologie am Max-Planck-Institut für Herz- und Lungenforschung hat nun mit ihrem Mitarbeiter Kishor Kumar Sivaraj diesen Faden wieder aufgenommen und neue Erkenntnisse zum molekularen Mechanismus des Blutgefäßwachstums gewonnen.
Dabei untersuchten die Max-Planck-Forscher neben der Angiogenese in Tumoren auch die Rolle von G13 beim physiologischen Gefäßwachstum. Dazu verglichen sie die Blutgefäßdichte in der Netzhaut in zwei unterschiedlichen Gruppen sechs Tage alter Mäuse. „Bei den Wildtyp-Mäusen verlief die Angiogenese auf der Netzhaut wie erwartet. Bei Mäusen, bei denen das G13 ab dem ersten Tag nach der Geburt durch einen gentechnischen Eingriff ausschließlich in Endothelzellen ausgeschaltet war, blieb das Gefäßwachstum allerdings deutlich zurück“, so Wettschureck. Als Ursache hierfür konnten die Forscher eine reduzierte VEGFR-2 Dichte in den Endothelzellen verantwortlich machen.
Ein vergleichbares Ergebnis erhielt Wettschureck in einem Tumormodell. So wuchs ein unter die Haut implantierter Tumor bei Mäusen mit ausgeschaltetem G13-Gen wesentlich langsamer als bei genetisch unveränderten Mäusen. Dies ging wiederum einher mit einem reduzierten Gefäßwachstum bei den Mäusen ohne G13. „Unsere Daten zeigen, dass G13 wichtig ist für das Ablesen des VEGFR-2-Gens. Fehlt G13, wird in den Gefäßzellen kein VEGFR-2 gebildet und deren Wachstum unterdrückt“, sagt Wettschureck.
Der G13-Mechanismus bietet sich nach Wettschurecks Worten für die Entwicklung neuer Therapien an. „Unsere Ergebnisse zeigen, dass der Verlust von G13 in Endothelzellen zu einer effizienten Hemmung der Gefäßneubildung im Rahmen des Tumorwachstums führt, während andere Gefäßfunktionen, wie z.B. Blutdruckregulation, nicht gestört sind“, so Wettschureck. Deshalb wollen die Bad Nauheimer Wissenschaftler jetzt untersuchen, auf welche Weise sich eine Endothelzell-spezifische Hemmung des G13-vermittelten Signalweges in Menschen bewerkstelligen lässt.