Des scientifiques découvrent la fonction d'un mystérieux composant du VIH
Des chercheurs découvrent comment la couche matricielle du VIH-1 devient mature
Des chercheurs de l'Institut Max Planck de biochimie ont découvert le mécanisme d'une étape importante du cycle de vie du VIH. En collaboration avec des équipes des universités de Heidelberg et de Yale, ils ont découvert que l'énigmatique "peptide espaceur 2", l'un des composants du virus, joue un rôle clé dans la conversion des particules immatures du VIH-1 en particules infectieuses. Les résultats de l'étude ont été publiés dans la revue Nature.
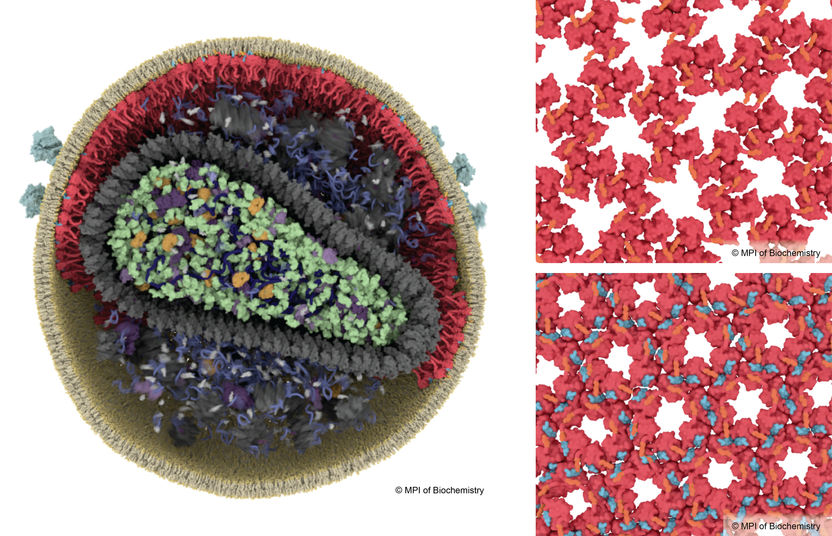
Pour devenir infectieux, le VIH doit subir un processus de maturation qui implique un réarrangement des protéines de la matrice (rouge). Dans une particule virale immature, les protéines matricielles forment un réseau perdu (en haut à droite), tandis que dans un VIH mature, la formation d'un nouveau réseau stable est déclenchée par la fixation du peptide espaceur 2 (en bleu, en bas à droite).
Margot Riggi, MPI of Biochemistry
Les particules de VIH-1 sont libérées des cellules infectées sous une forme immature et non infectieuse. Le principal matériau de construction d'une particule virale est constitué d'environ 2 000 copies d'une longue protéine en forme de bâton appelée Gag. Pour devenir infectieux, le VIH doit subir un processus de maturation. Ce processus fait intervenir la protéase du VIH-1 (une enzyme virale), qui découpe la protéine Gag en six protéines plus petites, dont la protéine de la capside et la protéine de la matrice. Ce processus entraîne un réarrangement structurel considérable des composants du virus.
Pendant de nombreuses années, les scientifiques ont étudié les changements structurels de la capside du virus, qui renferme le génome. En revanche, on en sait beaucoup moins sur la matrice du virus - la coque protéique externe située directement sous la membrane lipidique qui enveloppe le virus. Les chercheurs dirigés par John Briggs, directeur et biologiste structurel à l'Institut Max Planck de biochimie, ont maintenant découvert comment la protéine matricielle se réarrange au cours de la maturation en particule infectieuse.
Ils ont utilisé les derniers microscopes cryo-électroniques pour obtenir des images des particules virales, puis ont eu recours à l'analyse informatique des images pour obtenir des modèles 3D très détaillés des protéines virales. De manière inattendue, ils ont découvert que le réarrangement de la matrice est déclenché par le "peptide espaceur 2", qui adhère à la matrice et la fait s'agglutiner différemment. Le peptide espaceur 2 est un autre des six composants formés par le découpage de Gag, mais sa fonction était inconnue jusqu'à présent. La liaison du peptide espaceur 2 à la protéine de la matrice permet au virus de fusionner plus rapidement avec les cellules cibles. Les travaux ont été réalisés en collaboration avec des partenaires de l'université de Heidelberg et de l'université de Yale, aux États-Unis.
John Briggs explique : "Dans notre laboratoire, nous avons obtenu les premières données structurelles sur la matrice en 2021, mais nous ne savions pas ce qui provoquait son réarrangement lorsque le virus mûrissait. Dans cette nouvelle étude, nous avons obtenu des vues 3D beaucoup plus détaillées de la couche matricielle, ce qui est essentiel pour comprendre ce qui se passe."
James Stacey et Dominik Hrebík, les deux premiers auteurs de l'étude, expliquent leurs conclusions. James déclare : "La matrice du virus possède une poche dans sa forme mature. Nous savions que quelque chose s'y liait, mais nous pensions qu'il s'agissait d'un lipide de la membrane. Nous voyons maintenant qu'il s'agit du peptide espaceur 2. Nous nous demandons si cette poche pourrait être une cible pour des molécules médicamenteuses à l'avenir". Dominik ajoute : "Jusqu'à présent, la fonction du peptide espaceur 2 n'était pas connue. Grâce à la cryo-microscopie électronique à haute résolution, nous avons constaté que ce peptide, après sa libération, se lie directement aux protéines de la matrice et relie les protéines entre elles dans le virus mature."
John Briggs résume : "Le VIH-1 est probablement le virus le plus étudié, mais il y a encore des étapes importantes de sa réplication que nous ne comprenons pas encore."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
James C. V. Stacey, Dominik Hrebík, Elizabeth Nand, Snehith Dyavari Shetty, Kun Qu, Marius Boicu, Maria Anders-Össwein, Pradeep D. Uchil, Robert A. Dick, Walther Mothes, Hans-Georg Kräusslich, Barbara Müller, John A. G. Briggs; "The conserved HIV-1 spacer peptide 2 triggers matrix lattice maturation"; Nature, 2025-2-26


















































