Une bionanomachine pour la chimie verte
Un mécanisme simple pour une réaction compliquée
Des scientifiques de l’Institut Paul Scherrer PSI ont caractérisé précisément, et pour la première fois, l’isomérase d’oxyde de styrène, une enzyme qui permet de produire des produits chimiques de valeur et des précurseurs de médicaments, tout en ménageant l’environnement. Cette enzyme pourrait devenir un nouvel instrument essentiel pour l’économie circulaire et la chimie verte. Leur étude paraît dans la revue spécialisée Nature Chemistry.
Les enzymes sont des biomolécules efficaces qui permettent de produire de nombreuses substances dans les conditions de notre environnement. Elles rendent possible une chimie «verte», qui réduit l’impact environnemental des procédés de chimie de synthèse classiques. Des scientifiques viennent de caractériser un outil de ce genre venu de la nature: l’isomérase d’oxyde de styrène. Cette enzyme est l’équivalent biologique du réarrangement de Meinwald, une réaction chimique importante en chimie organique.
«Cette enzyme avait déjà été découverte il y a plusieurs décennies, explique Richard Kammerer du Laboratoire de recherche biomoléculaire du PSI. Elle est produite par des bactéries.» Sa collègue Xiaodan Li ajoute: «Mais comme on ignorait son mode de fonctionnement, son domaine d’application restait limitée, jusqu’ici.» Les deux scientifiques et leur équipe ont déchiffré la structure et le mode de fonctionnement de cette enzyme.
Un mécanisme simple pour une réaction compliquée
Les microorganismes possèdent de nombreuses enzymes inhabituelles qui leur permettent, par exemple, de décomposer les substances nocives et de les utiliser comme nutriments. L’isomérase d’oxyde de styrène fait elle aussi partie de ces enzymes. Avec deux autres enzymes, elle permet à certaines bactéries environnementales de croitre sur le styrène, un hydrocarbure.
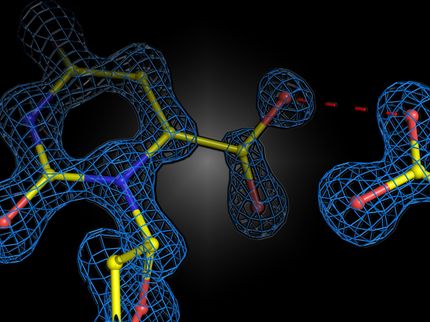
Lors de cette transformation, l’isomérase d’oxyde de styrène catalyse une étape de réaction spécifique : dans l’oxyde de styrène, elle scinde ce qu’on appelle l’époxyde, c’est-à-dire un cycle à trois chaînons composé d’un atome d’oxygène et de deux atomes de carbone. Ce faisant, l’enzyme ne génère qu’un seul produit à la fois. Elle peut également convertir une série de substances supplémentaires, générant des produits qui sont d’importants précurseurs pour des applications médicales.
Le point particulier réside dans le fait que de nombreuses réactions chimiques peuvent produire à la fois l’image et l’image miroir d’un composé chimique, dont l’effet biologique peut être très différent. Toutefois, l’enzyme ne produit spécifiquement qu’un seul des deux produits. En chimie, cette propriété est appelée la stéréospécificité : elle est extrêmement importante, notamment, pour les molécules précurseurs de médicaments. «Cette enzyme est un exemple impressionnant de la simplicité et de l’ingéniosité que la nature met en œuvre pour permettre certaines réactions chimiques», estime Xiaodan Li.
Très polyvalente
Au fil de leurs analyses, qu’ils ont menées en partie à la Source de Lumière Suisse SLS, les scientifiques du PSI ont découvert le secret de cette enzyme : elle contient un groupe ferreux semblable à l’hémoglobine, le pigment ferreux dans nos globules rouges. Ce groupe hème lie le groupe époxyde, ce qui rend la réaction si simple et si efficace. D'autres études ont été menées par le groupe de Volodymyr Korkhov, également du laboratoire de recherche biomoléculaire du PSI et professeur associé au département de biologie de l'ETH Zurich, en utilisant la cryomicroscopie électronique.
Xiaodan Li et Richard Kammerer sont certains que l’enzyme sera extrêmement utile dans l’industrie chimique et pharmaceutique. «Il s’agit de la seule enzyme bactérienne connue à ce jour qui catalyse le réarrangement de Meinwald», souligne Richard Kammerer. L’industrie pourrait utiliser cette enzyme pour fabriquer, par exemple, des précurseurs de médicaments et d’importants produits chimiques dans des conditions économes en énergie et respectueuses de l’environnement.
«Potentiellement, l’enzyme peut être modifiée pour pouvoir produire toute une série de nouvelles substances», ajoute Xiaodan Li. Par ailleurs, elle est très stable et donc utilisable à grande échelle. Les scientifiques du PSI en sont convaincus: «Elle deviendra certainement un outil essentiel pour l’économie circulaire et la chimie verte.»
Publication originale
Basavraj Khanppnavar, Joel P. S. Choo, Peter-Leon Hagedoorn, Grigory Smolentsev, Saša Štefanić, Selvapravin Kumaran, Dirk Tischler, Fritz K. Winkler, Volodymyr M. Korkhov, Zhi Li, Richard A. Kammerer, Xiaodan Li; "Structural basis of the Meinwald rearrangement catalysed by styrene oxide isomerase"; Nature Chemistry, 2024-5-14