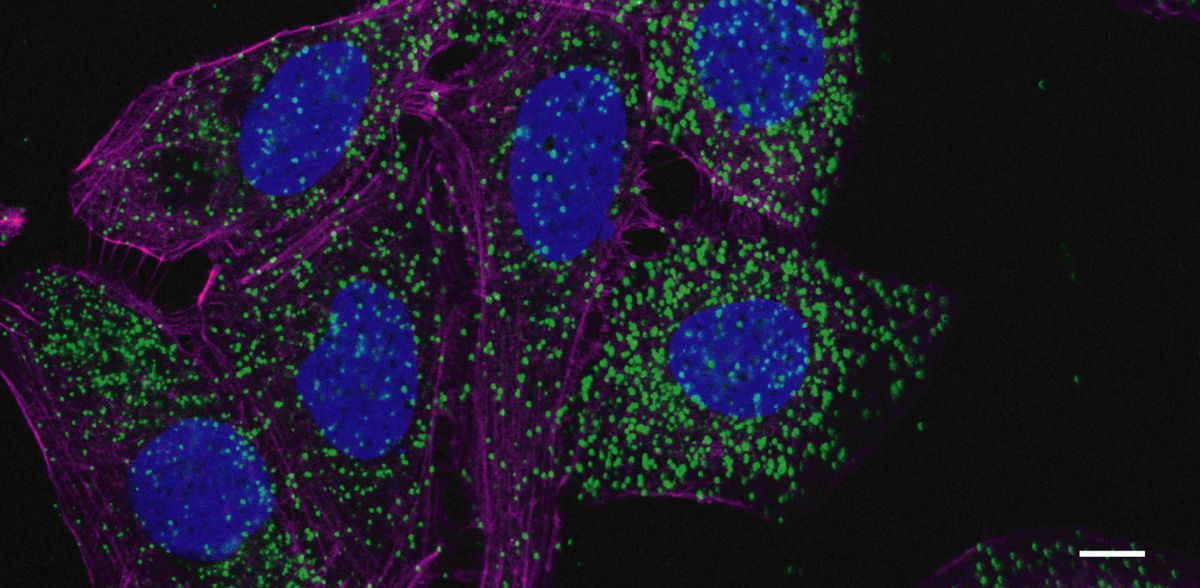
Les cellules leucémiques activent le programme de recyclage cellulaire
Ces résultats ouvrent la voie à de nouvelles options thérapeutiques pour l'avenir
Pour accélérer leur croissance, les cellules leucémiques activent généralement le recyclage des structures cellulaires, ce qui leur permet de se débarrasser des composants défectueux et de mieux s'approvisionner en matériaux de construction. Des chercheurs de l'université Goethe de Francfort viennent de montrer que les cellules leucémiques présentant une mutation très courante activent des gènes spécifiques importants pour ce processus de recyclage. Leurs conclusions, publiées dans la revue Cell Reports, ouvrent la voie à de nouvelles options thérapeutiques pour l'avenir.
Dans une étude récente, des scientifiques dirigés par le professeur Stefan Müller de l'Institut de biochimie II de l'université Goethe ont étudié une forme particulière de cancer du sang, la leucémie myéloïde aiguë (LMA). Cette maladie survient principalement à l'âge adulte et finit souvent par être fatale pour les patients les plus âgés. Chez environ un tiers des patients atteints de LAM, le matériel génétique des cellules cancéreuses présente une mutation caractéristique qui affecte le gène NPM1, lequel contient les instructions de construction d'une protéine du même nom.
Alors que l'on savait déjà que la variante mutée du gène NPM1 (abrégée en NPM1c) était un facteur important dans le développement de la leucémie, "avec une équipe interdisciplinaire composée de plusieurs groupes de recherche de l'université Goethe, nous avons maintenant découvert une nouvelle façon dont la variante du gène NPM1c joue ce rôle", explique Müller. La protéine altérée intervient dans l'autophagie, un processus cellulaire important qui consiste en une voie métabolique par laquelle la cellule recycle ses propres structures. D'une part, cette "autodigestion" sert à éliminer les molécules défectueuses. "D'autre part, elle permet à la cellule de répondre à ses besoins en éléments constitutifs importants, notamment en cas de carence en nutriments ou de prolifération cellulaire accrue, caractéristique des cellules cancéreuses", explique Hannah Mende, étudiante en doctorat et premier auteur de l'étude.
Au cours de l'autophagie, la cellule produit d'abord une sorte de sac à déchets, l'autophagosome, dans lequel elle entasse les composants cellulaires qui doivent être décomposés et recyclés si nécessaire. Ce sac à déchets est ensuite transporté vers le centre de recyclage de la cellule, le lysosome, où son contenu est décomposé à l'aide d'acides et d'enzymes. De là, les éléments constitutifs sont libérés dans la cellule, où ils peuvent être réutilisés. "Nous avons pu démontrer que NPM1c favorise la production d'autophagosomes et de lysosomes", explique Müller.
Les chercheurs ont également apporté une réponse à la question de savoir comment NPM1c produit ces effets : Il se lie à un régulateur central du système autophagosome-lysosome appelé GABARAP, et l'active ainsi. "À l'aide de simulations informatiques, nous avons montré que cette liaison entre NPM1c et GABARAP a une structure atypique", explique le Dr Ramachandra M. Bhaskara, co-auteur de l'étude et chef du groupe de travail sur la biologie cellulaire computationnelle de l'Institut de biochimie II. Les données expérimentales de biologie structurale confirment les résultats de la simulation, sur la base desquels il pourrait être possible de développer des substances actives qui influencent spécifiquement la liaison de NPM1c à GABARAP et luttent ainsi contre la croissance des cellules leucémiques.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Hannah Mende, Anshu Khatri, Carolin Lange, Sergio Alejandro Poveda-Cuevas, Georg Tascher, Adriana Covarrubias-Pinto, Frank Löhr, Sebastian E. Koschade, Ivan Dikic, Christian Münch, Anja Bremm, Lorenzo Brunetti, Christian H. Brandts, Hannah Uckelmann, Volker Dötsch, Vladimir V. Rogov, Ramachandra M. Bhaskara, Stefan Müller; "An atypical GABARAP binding module drives the pro-autophagic potential of the AML-associated NPM1c variant"; Cell Reports, Volume 42