Petite protéine, grand impact
Une petite protéine agit comme une alarme sensible pour les bactéries afin de les mettre en garde contre les peptides antimicrobiens
La nature utilise les peptides antimicrobiens comme des antibiotiques à large spectre : Ils constituent la première ligne de défense contre les agents pathogènes envahissants. Les bactéries, quant à elles, ont développé des moyens de contourner ces défenses. Des microbiologistes de l'Institut Max Planck de Marburg ont étudié comment une petite protéine permet aux bactéries de reconnaître avec sensibilité les peptides antimicrobiens et de se défendre efficacement. Leur étude fournit la base moléculaire pour le développement de nouveaux agents à base de peptides.
Les petites protéines ont généralement une longueur inférieure à 50 acides aminés. En raison de leur petite taille, elles ont été largement négligées dans le passé. Les progrès de la bio-informatique et du profilage ribosomique ont révélé que des centaines, voire des milliers de petites protéines sont produites dans les bactéries, les archées, les eucaryotes et les communautés microbiennes. Des études ont montré qu'elles fonctionnent principalement comme régulateurs de divers processus et voies biologiques.
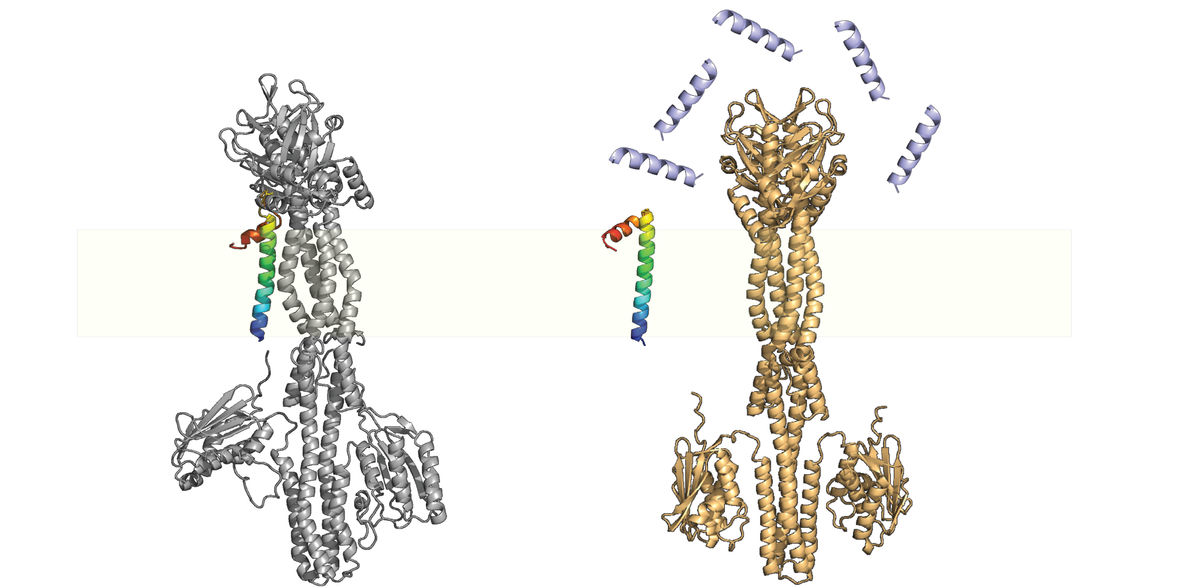
Jing Yuan, chef du groupe de projet à l'Institut Max Planck de microbiologie terrestre, qualifie les petites protéines de "gadgets de la nature". Son équipe étudie notamment une petite protéine importante appelée MgrB. Cette dernière est une protéine membranaire qui détecte les signaux environnementaux associés à l'hôte, tels que la limitation du magnésium, la diminution du pH, l'augmentation de l'osmolarité, les acides gras insaturés à longue chaîne provenant de la bile et les peptides antimicrobiens. Avec un système PhoQ/PhoP fonctionnant correctement, les bactéries pathogènes peuvent activer le programme de virulence et échapper au système immunitaire à l'intérieur de l'hôte mammifère au bon moment et au bon endroit. Le système à deux composantes PhoQ/PhoP est donc un régulateur principal du programme de virulence, et l'interaction de MgrB affecte la virulence bactérienne, la forme physique et la résistance aux médicaments. Mais comment cela se passe-t-il exactement ?
Lorsque les bactéries envahissent l'hôte, le système PhoQ/PhoP est activé en raison de la concentration physiologique relativement faible de magnésium, qui induit alors l'expression de mgrB, ce qui entraîne une répression partielle du système PhoQ/PhoP. En présence de peptides antimicrobiens (par exemple dans la couche de mucus intestinal ou à l'intérieur des macrophages), MgrB se dissocie de PhoQ, libère l'effet inhibiteur et déclenche l'activation complète de la voie PhoQ/PhoP.
L'équipe de recherche, en collaboration avec des collègues de l'université de Berne, en Suisse, a maintenant montré que l'inhibition de PhoQ par MgrB stabilise le système en fournissant une rétroaction négative. Sans MgrB, le système PhoQ/PhoP est hyperactif et n'est plus sensible aux niveaux subinhibiteurs de peptides antimicrobiens.
"C'est comme si une personne lançait ses poings dans le noir, sans savoir si elle est en sécurité ou si elle risque d'être attaquée", explique Jing Yuan. "Nos résultats démontrent l'importance d'une si petite protéine pour l'aptitude bactérienne et la résistance aux médicaments. En outre, ils fournissent également la base moléculaire pour l'ingénierie de nouveaux régulateurs à base de peptides afin de contrôler la virulence bactérienne et la résistance aux médicaments.
En modifiant les propriétés de MgrB, le groupe de Yuan développe actuellement de nouveaux régulateurs peptidiques qu'il appelle Super MgrB. Les Super-MgrB devraient se lier de manière permanente à PhoQ, l'inhibant ainsi. Cela supprimerait complètement le système PhoQ/PhoP et maintiendrait le programme de défense bactérienne dans un état d'arrêt. Les chercheurs supposent que les Super-MgrB pourraient empêcher la reconnaissance des peptides antimicrobiens, ce qui rendrait les bactéries pathogènes plus vulnérables.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.