Des protéines malveillantes protègent le génome
Un réseau dynamique dans les pores de l'enveloppe nucléaire bloque les envahisseurs dangereux
De minuscules pores dans le noyau cellulaire jouent un rôle essentiel dans le vieillissement sain en protégeant et en préservant le matériel génétique. Une équipe allemande du département de biophysique théorique de l'Institut Max Planck de biophysique de Francfort-sur-le-Main et du groupe de biophysique synthétique du désordre protéique de l'université Johannes Gutenberg de Mayence a littéralement comblé un vide dans la compréhension de la structure et de la fonction de ces pores nucléaires. Les scientifiques ont découvert comment les protéines intrinsèquement désordonnées au centre du pore peuvent former une barrière mobile en forme de spaghetti qui est perméable aux facteurs cellulaires importants mais bloque les virus ou autres agents pathogènes.
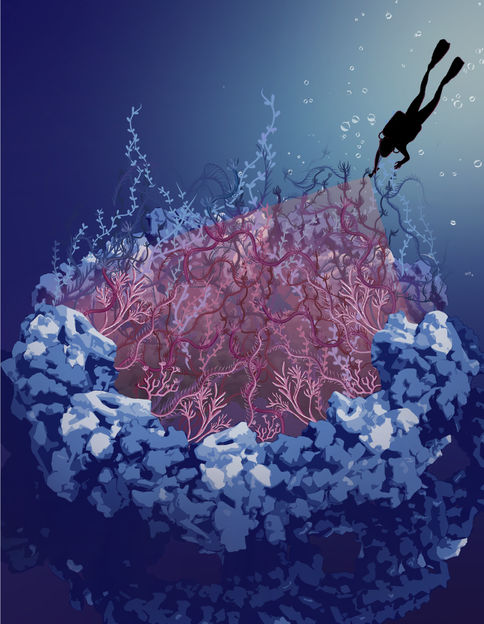
L'image montre une impression artistique de la structure rocheuse du complexe du pore nucléaire remplie de protéines intrinsèquement désordonnées dans le canal central représenté par des algues. Dans ce travail, nous avons "plongé" dans le trou sombre du complexe du pore nucléaire pour mettre en lumière les protéines désordonnées.
© Sara Mingu
Les cellules humaines abritent leur matériel génétique à l'intérieur du noyau cellulaire, protégé par la membrane nucléaire. En tant que centre de contrôle de la cellule, le noyau doit pouvoir échanger d'importantes molécules messagères, des métabolites ou des protéines avec le reste de la cellule. Environ 2000 pores sont donc intégrés à la membrane nucléaire, chacun d'entre eux étant constitué d'environ 1000 protéines.
Depuis des décennies, les chercheurs sont fascinés par la structure tridimensionnelle et la fonction de ces pores nucléaires, qui agissent comme des gardiens du génome : les substances nécessaires au contrôle de la cellule sont autorisées à passer, tandis que les agents pathogènes ou d'autres substances endommageant l'ADN sont empêchés d'entrer. Les pores nucléaires peuvent donc être considérés comme des videurs moléculaires, chacun contrôlant plusieurs milliers de visiteurs par seconde. Seuls ceux qui possèdent un ticket d'entrée sont autorisés à passer.
Comment les pores nucléaires parviennent-ils à accomplir cette tâche gigantesque ? Environ 300 protéines attachées à l'échafaudage du pore s'enfoncent dans l'ouverture centrale comme des tentacules. Jusqu'à présent, les chercheurs ne savaient pas comment ces tentacules étaient disposés et comment ils repoussaient les intrus. En effet, ces protéines sont intrinsèquement désordonnées et n'ont pas de structure tridimensionnelle définie. Elles sont flexibles et se déplacent continuellement - comme des spaghettis dans l'eau bouillante.
Combinaison de la microscopie et des simulations informatiques
Comme ces protéines intrinsèquement désordonnées (PID) changent constamment de structure, il est difficile pour les scientifiques de déchiffrer leur architecture tridimensionnelle et leur fonction. La plupart des techniques expérimentales utilisées par les chercheurs pour imager les protéines ne fonctionnent qu'avec une structure 3D définie. Jusqu'à présent, la région centrale du pore nucléaire était représentée par un trou, car il n'était pas possible de déterminer l'organisation des IDP dans l'ouverture.
L'équipe dirigée par Gerhard Hummer, directeur de l'Institut Max Planck de biophysique, et Edward Lemke, professeur de biophysique synthétique à l'université Johannes Gutenberg de Mayence et directeur adjoint de l'Institut de biologie moléculaire de Mayence, a désormais recours à une combinaison inédite de biologie synthétique, de microscopie à fluorescence multidimensionnelle et de simulations informatiques pour étudier les IDP du pore nucléaire dans des cellules vivantes.
"Nous avons utilisé des outils de précision modernes pour marquer plusieurs points des protéines en forme de spaghetti avec des colorants fluorescents que nous excitons par la lumière et visualisons au microscope", explique Lemke. "En nous basant sur les motifs et la durée de la fluorescence, nous avons pu déduire comment les protéines devaient être disposées. Hummer ajoute : "Nous avons ensuite utilisé des simulations de dynamique moléculaire pour calculer comment les IDP sont organisées spatialement dans le pore, comment elles interagissent les unes avec les autres et comment elles se déplacent. Pour la première fois, nous avons pu visualiser la porte du centre de contrôle des cellules humaines.
Un réseau de protéines dynamique comme barrière de transport
Les tentacules dans le pore de transport ont un comportement complètement différent de ce que nous connaissions auparavant, car ils interagissent entre eux et avec la cargaison. Ils se déplacent en permanence comme les spaghettis dans l'eau bouillante. Ainsi, au centre du pore, il n'y a pas de trou, mais un bouclier de molécules ondulantes, semblables à des spaghettis. Les virus ou les bactéries sont trop gros pour passer à travers ce tamis. En revanche, d'autres grosses molécules cellulaires nécessaires au noyau peuvent passer, car elles sont porteuses de signaux très spécifiques. Ces molécules ont un ticket d'entrée, alors que les agents pathogènes n'en ont généralement pas. "En démêlant le remplissage des pores, nous entrons dans une nouvelle phase de la recherche sur le transport nucléaire", ajoute Martin Beck, collaborateur et collègue à l'Institut Max Planck de biophysique.
"Comprendre comment les pores transportent ou bloquent les cargaisons nous aidera à identifier les erreurs. Après tout, certains virus parviennent à pénétrer dans le noyau cellulaire malgré la barrière", résume M. Hummer. "Grâce à notre combinaison de méthodes, nous pouvons maintenant étudier les IDP plus en détail pour comprendre pourquoi elles sont indispensables à certaines fonctions cellulaires, bien qu'elles soient sujettes à des erreurs. En fait, les IDP sont présentes dans presque toutes les espèces, même si elles risquent de former des agrégats au cours du processus de vieillissement, ce qui peut conduire à des maladies neurodégénératives telles que la maladie d'Alzheimer", explique M. Lemke. En découvrant le fonctionnement des IDP, les chercheurs visent à mettre au point de nouveaux médicaments ou vaccins pour prévenir les infections virales et favoriser un vieillissement en bonne santé.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.