La structure de l'enzyme "mangeuse de pétrole" ouvre la voie aux catalyseurs issus de la bio-ingénierie
Des détails au niveau atomique révèlent comment l'enzyme rompt sélectivement les liaisons hydrocarbonées, ce qui laisse entrevoir des stratégies de bio-ingénierie pour la fabrication de produits chimiques utiles.
Des scientifiques du laboratoire national Brookhaven du ministère américain de l'énergie ont produit la première structure au niveau atomique d'une enzyme qui coupe sélectivement les liaisons carbone-hydrogène, la première et la plus difficile étape de la transformation d'hydrocarbures simples en produits chimiques plus utiles. Décrit dans un article publié dans Nature Structural & Molecular Biology, le "plan" détaillé au niveau atomique suggère des moyens d'ingénierie de l'enzyme pour produire les produits souhaités.
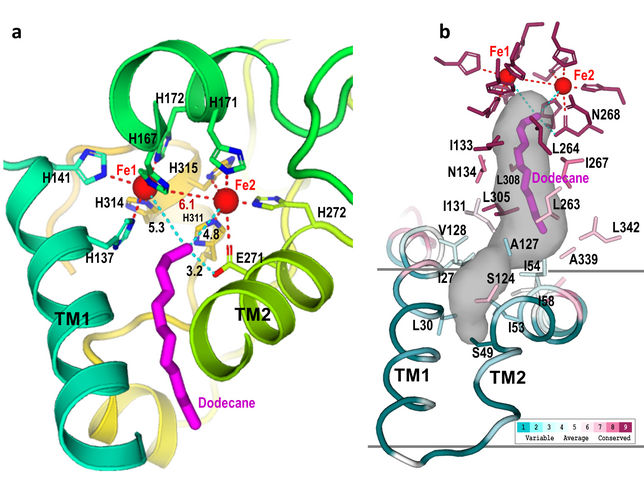
Site actif : Ces gros plans du site actif de l'AlkB montrent comment neuf acides aminés histidine (indiqués par "H" dans l'image de gauche) forment une cavité (région ombrée en gris, à droite). Cette cavité guide le substrat (magenta) vers le site actif (près des deux atomes de fer, Fe) dans une seule orientation, où seule la liaison carbone-hydrogène terminale peut être clivée. Modifier l'enzyme pour changer la forme de cette cavité pourrait permettre à l'enzyme d'attaquer différentes liaisons C-H.
Brookhaven National Laboratory
"Nous voulons créer un pool diversifié de biocatalyseurs où l'on peut sélectionner spécifiquement le substrat souhaité pour produire des produits recherchés et uniques à partir d'hydrocarbures abondants", a déclaré Qun Liu, un biologiste structurel du Brookhaven Lab, codirecteur de l'étude. "Cette approche nous donnerait un moyen contrôlable de convertir des alcanes abondants et bon marché - de simples composés carbone-hydrogène qui constituent 20 à 50 % du pétrole brut - en bioproduits ou précurseurs chimiques plus précieux, notamment des alcools, des aldéhydes, des carboxylates et des époxydes".
L'idée est particulièrement intéressante car la plupart des procédés catalytiques industriels utilisés pour la conversion des alcanes produisent des sous-produits indésirables et du dioxyde de carbone (CO2), un gaz qui retient la chaleur. Ils contiennent également des matériaux coûteux et nécessitent des températures et des pressions élevées. L'enzyme biologique, connue sous le nom d'AlkB, fonctionne dans des conditions plus ordinaires et avec une très grande spécificité. Elle utilise du fer peu coûteux et abondant sur terre pour initier la chimie tout en produisant peu de sous-produits indésirables.
"La nature a compris comment réaliser ce type de chimie avec un métal abondant et peu coûteux, à température et pression ambiantes", explique John Shanklin, directeur du département de biologie du laboratoire de Brookhaven et auteur principal de l'article. "En conséquence, cette enzyme a suscité un intérêt massif, mais on ne comprend pas du tout son architecture et son fonctionnement, ce qui est nécessaire pour la remodeler à de nouvelles fins. Grâce à cette structure, nous avons surmonté cet obstacle.
De l'huile rance au succès sucré
L'AlkB a été découverte il y a 50 ans dans un atelier d'usinage, où des bactéries digéraient l'huile de refroidissement, ce qui lui donnait une odeur de rance. Les biochimistes ont découvert que l'enzyme bactérienne AlkB était à l'origine de l'appétit inhabituel des microbes. Depuis lors, les scientifiques ont cherché à exploiter la capacité de l'AlkB à dévorer les hydrocarbures.
Au fil des ans, les études ont révélé que l'enzyme est partiellement intégrée dans les membranes des bactéries et qu'elle fonctionne en conjonction avec deux autres protéines. Shanklin et Liu, ainsi que d'autres scientifiques, ont tenté de résoudre la structure de l'enzyme à l'aide de la cristallographie aux rayons X. Cette méthode consiste à envoyer des rayons X à haute intensité dans l'espace et dans l'espace. Cette méthode consiste à faire rebondir des rayons X de haute intensité sur une version cristallisée d'une protéine afin d'identifier l'emplacement des atomes. Mais les protéines membranaires comme AlkB sont notoirement difficiles à cristalliser, surtout lorsqu'elles font partie d'un complexe multiprotéique.
"Nous n'avons pas pu obtenir une résolution suffisante", a déclaré M. Liu.
Début 2021, Brookhaven a ouvert sa nouvelle installation de cryo-microscopie électronique (cryo-EM), le Laboratory for BioMolecular Structure (LBMS). Les scientifiques ont utilisé un cryomicroscope électronique, qui ne nécessite pas d'échantillon cristallisé, pour prendre des photos de quelques millions de molécules de protéines congelées sous différents angles. Des outils informatiques ont ensuite trié les images, identifié et calculé la moyenne des caractéristiques communes, pour finalement générer une carte tridimensionnelle à haute résolution du complexe enzymatique. À l'aide de cette carte, les scientifiques ont ensuite reconstitué les structures atomiques connues des différents acides aminés qui composent le complexe protéique afin de compléter les détails en trois dimensions.
L'identification des conditions adéquates pour stabiliser la région transmembranaire de l'enzyme et maintenir les détails structurels a été un défi qui a nécessité de nombreux essais et erreurs. Shanklin remercie Jin Chai, l'un des chercheurs de son laboratoire, "pour son engagement et sa détermination à résoudre cette énigme".
La structure révèle le fonctionnement de l'enzyme
La structure détaillée montre exactement comment AlkB et l'une des deux protéines associées (AlkG) travaillent ensemble pour couper les liaisons carbone-hydrogène. En fait, la structure résolue contient un bonus inattendu : une molécule d'alcane substrat qui a été piégée dans la cavité du site actif de l'enzyme.
"Notre structure montre comment les acides aminés qui composent cette enzyme forment une cavité qui oriente le substrat hydrocarboné de manière à ce qu'une seule liaison carbone-hydrogène spécifique puisse s'approcher du site actif", a déclaré M. Liu. "Il montre également comment les électrons se déplacent de la protéine porteuse (AlkG) vers le centre de di-fer du site actif de l'enzyme, ce qui lui permet d'activer une molécule d'oxygène pour attaquer cette liaison".
Shanklin suggère de considérer l'enzyme comme une machine à couper les liaisons, à l'instar d'une scie circulaire : "La façon dont vous tenez l'alcane par rapport au centre di-fer de l'enzyme détermine la façon dont l'oxygène activé interagit avec l'hydrocarbure. Si vous guidez l'extrémité de l'alcane contre l'oxygène activé, celui-ci va initier une certaine chimie sur le dernier carbone.
"L'ingénierie que nous voulons mettre en œuvre consiste à modifier la forme de la cavité du site actif de manière à ce que le substrat (ou un substrat différent) puisse approcher l'oxygène activé sous différents angles et à différents endroits de la liaison C-H afin de réaliser différentes réactions.
Dans la nature, notent les scientifiques, une troisième protéine non incluse dans cette structure (AlkT) fournit les électrons à AlkG, la protéine porteuse. La protéine porteuse transporte ensuite les électrons vers les deux atomes de fer qui activent l'oxygène sur le site actif d'AlkB. Selon eux, il serait plus simple et moins coûteux de remplacer la protéine donneuse d'électrons par une électrode pour fournir des électrons que d'utiliser le donneur d'électrons biologique.
Le DOE vient de financer la proposition de l'équipe visant à développer de tels "catalyseurs diiron biohybrides transformateurs pour la fonctionnalisation des liaisons C-H", en partie sur la base de ce travail structurel préliminaire.
"Cette structure et notre connaissance du fonctionnement du complexe AlkG/AlkB nous placent dans une position idéale pour bio-ingénieriser cette enzyme afin de sélectionner la liaison carbone-hydrogène activée dans une variété de substrats et de contrôler les électrons et l'oxygène afin de ré-ingénieriser sa sélectivité", a déclaré Liu.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.