Le SRAS-CoV-2 détourne les nanotubes entre les neurones pour les infecter
Infection des neurones en l'absence de récepteur
Le Covid-19 entraîne souvent des symptômes neurologiques, tels qu'une perte du goût ou de l'odorat, ou des troubles cognitifs (notamment des pertes de mémoire et des difficultés de concentration), tant pendant la phase aiguë de la maladie qu'à long terme avec le syndrome du "COVID long". Mais la manière dont l'infection atteint le cerveau était jusqu'alors inconnue. Des scientifiques de l'Institut Pasteur et de laboratoires du CNRS ont utilisé des approches de pointe en microscopie électronique pour démontrer que le SRAS-CoV-2 détourne les nanotubes, de minuscules ponts qui relient les cellules infectées aux neurones. Le virus est donc capable de pénétrer dans les neurones malgré le fait qu'ils soient dépourvus du récepteur ACE2 auquel le virus se lie habituellement lorsqu'il infecte les cellules.
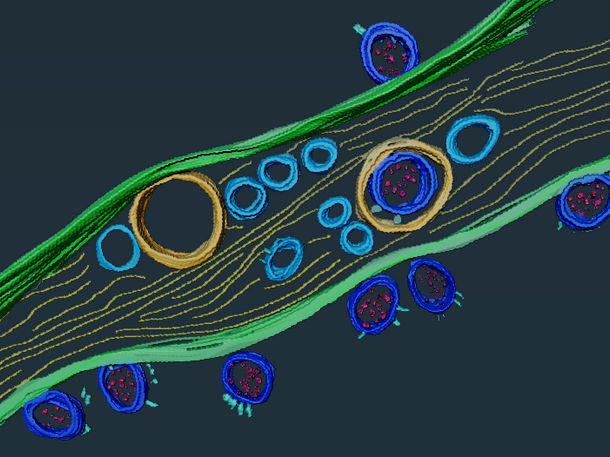
Particules virales du SRAS-CoV-2 (en bleu foncé) à l'intérieur et à la surface d'un nanotube. Images de tomographie cryo-électronique segmentées à l'aide du logiciel Amira.
Anna Pepe, Institut Pasteur
Comment le SRAS-CoV-2 pénètre-t-il dans les cellules du cerveau ? Une étude montre que le virus utilise les nanotubes qui se forment entre les cellules infectées et les neurones pour accéder à ces derniers. Ces structures dynamiques transitoires sont le résultat de la fusion des membranes des cellules distantes. Elles permettent l'échange de matériel cellulaire sans avoir recours aux récepteurs membranaires, le moyen normal d'entrer et de sortir du cytoplasme. L'unité "Trafic membranaire et pathogénie", dirigée par Chiara Zurzolo à l'Institut Pasteur, a déjà découvert que les nanotubes jouent un rôle dans les maladies dégénératives telles que les maladies d'Alzheimer et de Parkinson en facilitant le transport des protéines responsables de ces maladies.
Infecter les neurones en l'absence de récepteur
Bien que le récepteur cellulaire humain ACE2 serve de porte d'entrée au SRAS-CoV-2 dans les cellules pulmonaires - la principale cible du virus - et dans les cellules de l'épithélium olfactif, il n'est pas exprimé par les neurones. Or, du matériel génétique viral a été retrouvé dans le cerveau de certains patients, ce qui explique les symptômes neurologiques qui caractérisent le COVID aigu ou long. La muqueuse olfactive a déjà été suggérée comme une voie d'accès au système nerveux central, mais cela n'explique pas comment le virus est capable de pénétrer dans les cellules neuronales elles-mêmes.
Selon cette nouvelle étude, le SRAS-CoV-2 serait également capable d'induire la formation de nanotubes entre les cellules infectées et les neurones, ainsi qu'entre les neurones, ce qui expliquerait comment le cerveau est infecté à partir de l'épithélium. L'équipe de recherche a mis en évidence de multiples particules virales situées à l'intérieur et à la surface des nanotubes. Comme le virus se propage plus rapidement et directement à partir de l'intérieur des nanotubes qu'en sortant d'une cellule pour passer à la suivante via un récepteur, ce mode de transmission contribue donc à la capacité infectieuse du SRAS-CoV-2 et à sa propagation aux cellules neuronales.
Mais le virus se déplace également sur la surface externe des nanotubes, où il peut être guidé plus rapidement vers les cellules qui expriment des récepteurs compatibles. "Les nanotubes peuvent être vus comme des tunnels surmontés d'une route", suggère Chiara Zurzolo, responsable de l'unité Trafic membranaire et pathogénie de l'Institut Pasteur, "qui permettent l'infection de cellules non permissives comme les neurones mais facilitent également la propagation de l'infection entre les cellules permissives."
Des méthodes d'imagerie de pointe avec le microscope Titan Krios
Cette publication combine des recherches sur des cultures in vitro, montrant que les cellules neuronales saines sont infectées si elles entrent en contact avec des cellules infectées, avec l'utilisation d'outils de microscopie de pointe. Le microscope Titan Krios du NanoImaging Core Facility de l'Institut Pasteur offre une résolution sans précédent des échantillons biologiques et des nanomolécules, plus proche des conditions biologiques réelles. "Grâce à cet instrument, de nouvelles approches d'imagerie ont été développées pour évaluer la structure du SARS-CoV-2 et l'architecture des nanotubes", explique Anna Pepe de l'unité Trafic membranaire et pathogénie de l'Institut Pasteur, premier auteur de l'étude.
Travaillant en collaboration avec le centre de bio-imagerie ultrastructurale de l'Institut Pasteur, les équipes de recherche ont utilisé des méthodes d'investigation précises pour détecter des structures dans les nanotubes qui ont ensuite été identifiées comme des "usines à virus". Les nanotubes entre les neurones représentent un environnement propice au développement du SRAS-CoV-2, car il est invisible pour le système immunitaire. Chiara Zurzolo estime que "cela peut représenter un mécanisme d'évasion immunitaire et de persistance virale qui pourrait être favorable au virus."
Cette étude est un exemple de la manière dont la recherche interdisciplinaire fondamentale, impliquant des biologistes cellulaires, des virologues et des techniques d'imagerie de pointe, peut conduire à de nouvelles découvertes. Elle ouvre la voie à d'autres recherches sur le rôle de la communication intercellulaire dans la propagation du SRAS-CoV-2. Il encourage également l'exploration d'approches thérapeutiques alternatives pour entraver la propagation du SRAS-CoV-2, parallèlement aux projets actuels qui sont principalement axés sur le blocage de l'entrée par le récepteur ACE2.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.