Une nouvelle technique montre en détail où les molécules médicamenteuses atteignent leurs cibles dans l'organisme
La nouvelle méthode pourrait accélérer le développement de nombreux nouveaux médicaments
Les scientifiques du Scripps Research ont inventé un moyen d'imager, dans différents tissus et avec une précision jamais atteinte auparavant, l'endroit où les médicaments se lient à leurs cibles dans l'organisme. Cette nouvelle méthode pourrait devenir un outil de routine pour le développement de médicaments.
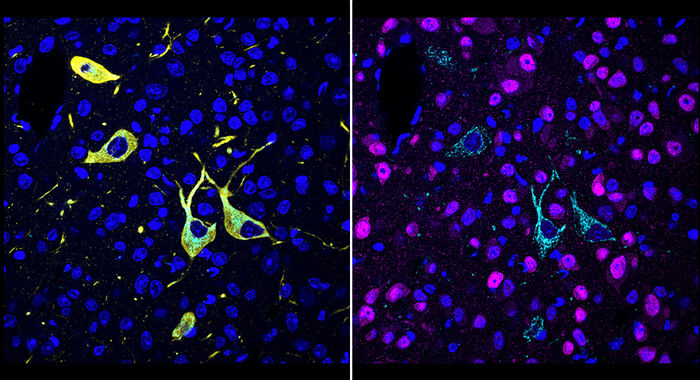
Une équipe du Scripps Research a inventé une nouvelle méthode, appelée CATCH, qui montre comment les médicaments atteignent leurs cibles dans l'organisme. Les cellules ciblées par un médicament (pargyline en cyan) peuvent être identifiées par de multiples séries d'immunomarquage (rouge pour les neurones, jaune pour les neurones dopaminergiques/noradrénergiques, bleu pour les noyaux cellulaires).
Scripps Research
Décrite dans un article paru dans Cell le 27 avril 2022, la nouvelle méthode, appelée CATCH, fixe des étiquettes fluorescentes aux molécules de médicaments et utilise des techniques chimiques pour améliorer le signal fluorescent. Les chercheurs ont fait la démonstration de la méthode avec plusieurs médicaments expérimentaux différents, révélant où - même dans les cellules individuelles - les molécules médicamenteuses atteignent leurs cibles.
"Cette méthode devrait finalement nous permettre, pour la première fois, de voir assez facilement pourquoi un médicament est plus puissant qu'un autre, ou pourquoi un médicament a un effet secondaire particulier alors qu'un autre ne l'a pas", explique l'auteur principal de l'étude, Li Ye, professeur adjoint de neurosciences au Scripps Research et titulaire de la chaire Abide-Vividion de chimie et de biologie chimique.
Le premier auteur de l'étude, Zhengyuan Pang, est un étudiant diplômé du laboratoire de Li Ye. L'étude est également le fruit d'une étroite collaboration avec le laboratoire de Ben Cravatt, PhD, titulaire de la chaire Gilula de biologie chimique au Scripps Research.
"L'environnement unique du Scripps Research, où les biologistes travaillent régulièrement avec des chimistes, est ce qui a rendu possible le développement de cette technique", explique Ye.
Comprendre où les molécules médicamenteuses se lient à leurs cibles pour exercer leurs effets thérapeutiques - et leurs effets secondaires - est un élément fondamental du développement des médicaments. Cependant, les études sur les interactions entre les médicaments et leurs cibles ont traditionnellement fait appel à des méthodes relativement imprécises, telles que les analyses en vrac de la concentration des molécules de médicaments dans des organes entiers.
La méthode CATCH consiste à insérer de minuscules poignées chimiques dans les molécules de médicaments. Ces poignées chimiques distinctes ne réagissent avec rien d'autre dans le corps, mais permettent l'ajout de marqueurs fluorescents après que les molécules de médicament se sont liées à leurs cibles. En partie parce que les tissus humains ou animaux ont tendance à diffuser et à bloquer la lumière de ces marqueurs fluorescents, Ye et son équipe ont combiné le processus de marquage avec une technique qui rend les tissus relativement transparents.
Dans cette étude initiale, les chercheurs ont optimisé et évalué leur méthode pour les "médicaments covalents", qui se lient de manière irréversible à leurs cibles par des liaisons chimiques stables appelées "liaisons covalentes". Cette irréversibilité de la liaison rend particulièrement important de vérifier que ces médicaments atteignent bien les cibles visées.
Les scientifiques ont d'abord évalué plusieurs inhibiteurs covalents d'une enzyme du cerveau appelée amide hydrolase d'acide gras (FAAH). Les inhibiteurs de la FAAH ont pour effet d'augmenter les niveaux de molécules cannabinoïdes, y compris l'anandamide, la "molécule de la félicité", et sont étudiés comme traitements de la douleur et des troubles de l'humeur. Les scientifiques ont été en mesure d'imager, au niveau de la cellule unique, l'endroit où ces inhibiteurs atteignent leurs cibles dans de grands volumes de tissu cérébral de souris, et ont pu facilement distinguer leurs différents modèles d'engagement de la cible.
Dans une expérience, ils ont montré qu'un inhibiteur expérimental de la FAAH appelé BIA-10-2474, qui a provoqué un décès et plusieurs blessures lors d'un essai clinique en France en 2016, engage des cibles inconnues dans le mésencéphale des souris, même lorsque celles-ci sont dépourvues de l'enzyme FAAH - ce qui donne un indice sur la source de la toxicité de l'inhibiteur.
Dans d'autres tests démontrant la précision et la polyvalence sans précédent de la nouvelle méthode, les scientifiques ont montré qu'ils pouvaient combiner l'imagerie médicament-cible avec des méthodes distinctes de marquage fluorescent pour révéler les types de cellules auxquelles un médicament se lie. Ils ont également pu distinguer les sites d'engagement de la cible du médicament dans différentes parties des neurones. Enfin, ils ont pu voir comment des doses légèrement différentes d'un médicament affectent souvent de manière frappante le degré d'engagement de la cible dans différentes zones du cerveau.
L'étude de démonstration de principe n'est qu'un début, souligne Ye. Lui et son équipe prévoient de poursuivre le développement de CATCH pour l'utiliser sur des échantillons de tissus plus épais, peut-être même sur des souris entières. En outre, ils prévoient d'étendre l'approche de base à des médicaments et à des sondes chimiques plus courants, ne se liant pas de manière covalente. Dans l'ensemble, Ye dit qu'il envisage la nouvelle méthode comme un outil de base non seulement pour la découverte de médicaments, mais aussi pour la biologie fondamentale.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Zhengyuan Pang et al.; In situ identification of cellular drug targets in mammalian tissue; Cell; 2022