Identificado el ‘talón de Aquiles’ del estafilococo dorado
Una investigación del Consejo Superior de Investigaciones Científicas (CSIC) y la Universidad de Notre Dame, en Indiana (Estados Unidos), ha caracterizado el mecanismo por el que el patógeno multirresistente Staphylococcus aureus, también conocido como estafilococo dorado o MRSA, por sus siglas en inglés, desarrolla resistencia a la mayor parte de los antibióticos convencionales. El estudio ha sido publicado en Proceedings of the National Academy of Sciences (PNAS).
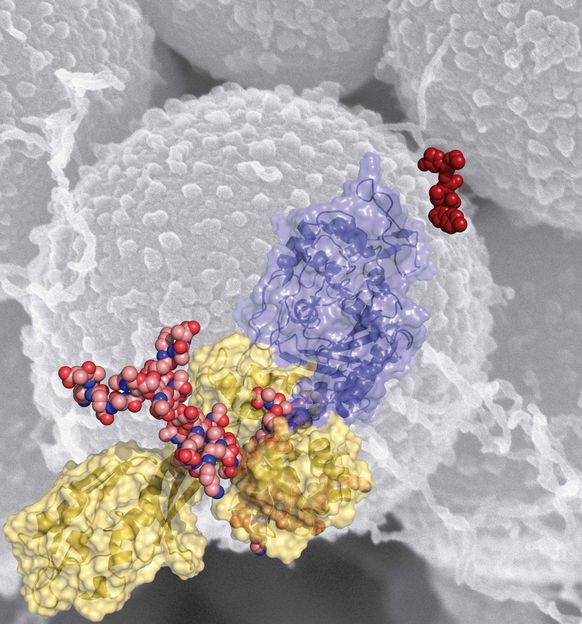
Estructura tridimensional de la proteína PBP2a de MRSA.
CSIC
“Este patógeno es el responsable de un gran número de enfermedades que van desde afecciones en la piel e infecciones en heridas, hasta neumonías y septicemias que pueden provocar la muerte. Las infecciones relacionadas con MRSA son de las más importantes entre los patógenos multirresistentes debido a la alta mortalidad que causa anualmente. Según datos recogidos en Estados Unidos, el estafilococo dorado causa más de de 80.000 infecciones cada año, de las cuales más de 11.000 acaban con el fallecimiento del paciente”, explica el investigador del CSIC Juan Hermoso, del Instituto de Química-Física Rocasolano.
Según este estudio, la clave de la resistencia de MRSA a los antibióticos beta-lactámicos (como los derivados de la penicilina) es la proteína PBP2a, que está implicada en la biosíntesis de la pared bacteriana del patógeno. En bacterias susceptibles a estos antibióticos las proteínas encargadas de la construcción de dicha pared se ven bloqueadas por los agentes y dejan de reproducirse. Sin embargo, en el caso del Staphylococcus aureus, PBP2a es insensible a ese bloqueo y permite al patógeno continuar con su ciclo celular aún en presencia de antibióticos.
El mecanismo que permite a PBP2a resistir a la mayoría de los antibióticos está relacionado con un sitio alósterico, es decir, un sitio muy lejano al sitio activo de la enzima pero capaz de controlar su activación. Mediante cristalografía de rayos X los investigadores han determinado la estructura tridimensional de PBP2a en complejo con ceftarolina, uno de los pocos antibióticos que son hoy efectivos frente al MRSA.
“Esta estructura ha revelado que la unión de la ceftarolina con el sitio alostérico produce toda una serie de cambios en la proteína que la activan y la dejan sensible a la inactivación por parte del antibiótico. Es como un interruptor que activa la enzima: los antibióticos convencionales no pueden encender ese interruptor, por lo que son inocuos para el patógeno. Este estudio describe cómo se produce este encendido y abre una nueva vía para el desarrollo de nuevos antibióticos”, añade Hermoso.
Publicación original
Noticias más leídas
Publicación original
Lisandro H. Oteroa, Alzoray Rojas-Altuvea, Leticia I. Llarrull, Cesar Carrasco-López, Malika Kumarasiri, Elena Lastochkin, Jennifer Fishovitz, et al.; "How allosteric control of Staphylococcus aureus penicillin binding protein 2a enables methicillin resistance and physiological function."; PNAS.
Organizaciones
Más noticias del departamento ciencias

Reciba la industria de las ciencias biológicas en su bandeja de entrada
Al enviar el formulario, se muestra usted de acuerdo con que LUMITOS AG le envíe por correo electrónico el boletín o boletines seleccionados anteriormente. Sus datos no se facilitarán a terceros. El almacenamiento y el procesamiento de sus datos se realiza sobre la base de nuestra política de protección de datos. LUMITOS puede ponerse en contacto con usted por correo electrónico a efectos publicitarios o de investigación de mercado y opinión. Puede revocar en todo momento su consentimiento sin efecto retroactivo y sin necesidad de indicar los motivos informando por correo postal a LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlín (Alemania) o por correo electrónico a revoke@lumitos.com. Además, en cada correo electrónico se incluye un enlace para anular la suscripción al boletín informativo correspondiente.



















































