Descubren cómo las células del sistema inmunitario reconocen la etiqueta que marca a los patógenos para que sean destruidos
Un estudio de investigadores del CIB-CSIC describe a nivel atómico cómo interactúan y se reconocen dos proteínas clave para la lucha contra las infecciones
Científicos del Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC), del CSIC, han colaborado para explicar a nivel atómico cómo funciona uno de los mecanismos más importantes con los que el sistema inmunitario reconoce a los patógenos. El estudio, publicado en Nature Communications, revela cómo los receptores CR3 en la superficie de los macrófagos y otras células inmunitarias reconocen la molécula iC3b con la que el sistema del complemento etiqueta a los patógenos para que sean destruidos mediante fagocitosis. Este hallazgo puede contribuir a desarrollar estrategias contra enfermedades autoinmunes e inflamatorias.
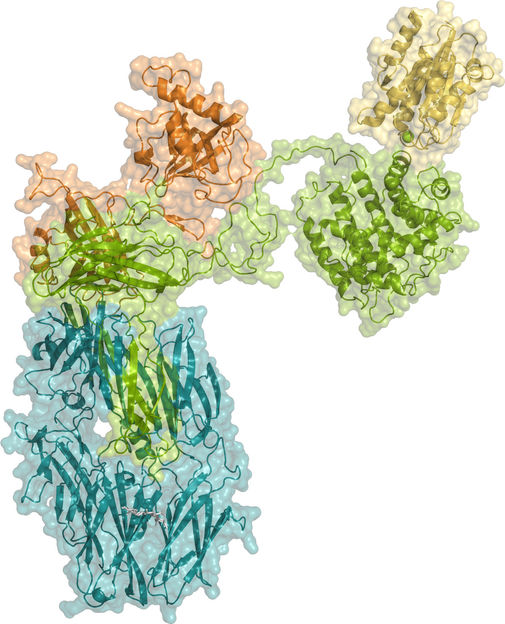
Estructura cristalográfica de iC3b en complejo con el dominio αI de CR3.
CIB-CSIC
El sistema del complemento es un componente fundamental de la inmunidad innata de los seres humanos. Está formado por más de 30 proteínas en plasma, además de receptores y reguladores en la membrana de muchas células, y se activa por la presencia de patógenos y otras sustancias que reconoce como extrañas. “Es nuestra primera defensa contra las infecciones por patógenos y su misión es etiquetar los patógenos con señales moleculares para su destrucción”, indica la investigadora del CIB-CSIC M. Cristina Vega, autora principal del estudio.
Cuando el complemento se activa sobre la superficie de los patógenos, la proteína C3, una de las proteínas más abundantes en el plasma, sufre una serie de transformaciones que conducen a la fijación covalente de miles de moléculas de C3 activadas sobre la superficie del patógeno (opsonización). La principal proteína fijada u opsonina es iC3b, una de las moléculas de C3 activadas.
La opsonización es esencial para combatir la infección, ya que las células efectoras del sistema inmunitario son capaces de reconocer a los patógenos opsonizados con iC3b como una amenaza, adhiriéndose a ellos y fagocitándolos. Con este fin, los macrófagos emplean una proteína compleja presente en su superficie conocida como el receptor 3 de complemento (CR3). La interacción entre iC3b y CR3 es por tanto responsable de la adhesión y fagocitosis de los patógenos recubiertos de iC3b por los macrófagos. En el trabajo que presentan los investigadores del CIB-CSIC se revelan los detalles moleculares de cómo se produce esta interacción entre iC3b y CR3.
“Con este trabajo hemos descubierto que la interacción de las proteínas iC3b y CR3 es de carácter modular. Esta modularidad confiere una gran versatilidad y especificidad a la interacción, favoreciendo el reconocimiento del patógeno en zonas con una elevada densidad de moléculas de iC3b. Un mal funcionamiento de estas proteínas puede provocar mayor susceptibilidad a infecciones y enfermedades raras autoinmunes”, explica Vega.
Aunque se conocía la función general de iC3b, su estructura atómica, así como los detalles de la especificidad y reconocimiento de iC3b por CR3 eran desconocidas. Este nuevo estudio completa la información sobre estas dos proteínas clave para la lucha contra las infecciones. “La resolución de la estructura de este complejo representa un paso importante para entender cómo las células del sistema inmune aprovechan la actividad del sistema del complemento para detectar y destruir patógenos, un proceso fundamental para preservar la salud frente a muchos agentes infecciosos” indica Francisco J. Fernández, primer autor del trabajo.
“El trabajo resalta la importancia de mantener un aporte continuo de moléculas de iC3b a la superficie de los patógenos por el sistema del complemento, lo que explica datos previos que no entendíamos completamente y plantea la posibilidad de intervenir en el sistema del complemento para favorecer este proceso” expone Santiago Rodríguez de Córdoba, profesor de investigación del CIB-CSIC y colaborador en este trabajo.
Los grupos de Vega y Rodríguez de Córdoba pertenecen a la Plataforma Salud Global del CSIC, donde colaboran en estudios dirigidos al tratamiento de los síntomas más graves de la covid-19 mediante estrategias centradas en el sistema del complemento. Los dos grupos han descrito previamente nuevos mecanismos de inmunoevasión en Streptococcus pyogenes y otras bacterias patógenas que interfieren con el papel de la proteína del complemento C5a, reduciendo la atracción de los neutrófilos a los sitios de infección. El trabajo que publican ahora facilitará el desarrollo de estrategias para modular la actividad de CR3 en enfermedades autoinmunes e inflamatorias.
Publicación original
Fernández FJ, Santos-López J, Martínez-Barricarte R, Querol-García J, Martín-Merinero H, Navas-Yuste S, Savko M, Shepard WE, Rodríguez de Córdoba S y Vega MC.; "The crystal structure of iC3b-CR3 αI reveals a modular recognition of the main opsonin iC3b by the CR3 integrin receptor."; Nature Communications.