Fábricas emergentes bajo la membrana celular
Los científicos han considerado durante mucho tiempo el líquido del citosol dentro de una célula como una gran "piscina" en la que todo flota libremente: Pero parece que estructuras hasta ahora desconocidas
En un estudio publicado en Cell, los investigadores del MDC muestran cómo una célula es capaz de procesar cientos de señales simultáneamente. Andreas Bock y sus colegas creen que sus hallazgos abrirán todo un nuevo campo de investigación en biología celular.
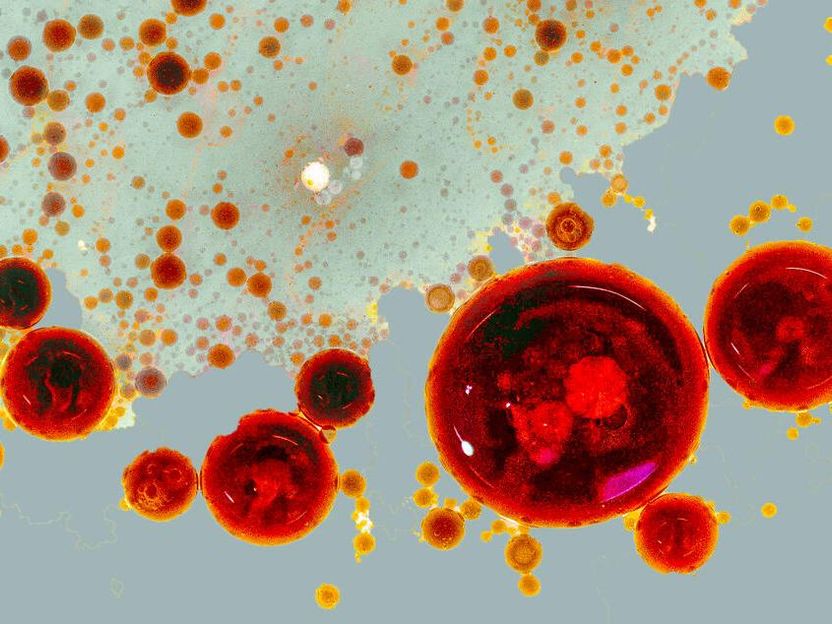
Una fotografía de una vinagreta: Las gotas de aceite simbolizan las fábricas emergentes (RAINs). Dependiendo de la intensidad de la señal, las RAIN pueden asumir diferentes tamaños y también fusionarse para luego desencadenar respuestas celulares globales.
© Lisa Maria Martin, Charlotte Kayser, MDC
Una célula viva está expuesta a diversos estímulos. Innumerables mensajeros se acoplan en su superficie, donde los receptores de la membrana celular reciben las "órdenes" entrantes. A continuación, se desencadenan cascadas de señalización en el interior de la célula, que en última instancia responde produciendo o descomponiendo sustancias, o activando o desactivando genes en el núcleo celular. Hasta aquí todo claro. Pero, ¿qué ocurre exactamente? Los investigadores del Centro Max Delbrück de Medicina Molecular de la Asociación Helmholtz (MDC) han descubierto ahora que los procesos son mucho más complejos de lo que se pensaba. Andreas Bock es el co-último autor del estudio que ha sido publicado en la revista Cell y recientemente dirigió el Laboratorio de Señalización de Receptores en el MDC. Ahora es profesor en la Universidad de Leipzig.
Hay más de 800 receptores diferentes acoplados a proteínas G (GPCR), que en conjunto constituyen el grupo más importante de proteínas de membrana. La superficie de una sola célula puede tener hasta 100 GPCR distintos, cada uno de los cuales responde a moléculas de señalización externas muy diferentes. "De modo que se tiene este altísimo nivel de especificidad en el exterior, pero sólo un puñado de moléculas dentro de la célula que responden a la activación", dice Bock. "Y, sin embargo, realizan tareas múltiples y completamente diferentes". Cómo funciona exactamente esto es algo que los científicos llevan mucho tiempo desconcertando.
Comunicación a través de espacios nanométricos
Una de las moléculas que actúa en el interior de la célula es el monofosfato de adenosina cíclico (AMPc). Si las células del músculo cardíaco se estimulan con adrenalina, por ejemplo, los niveles de AMPc aumentan, haciendo que el corazón lata más rápido y con más fuerza. Sin embargo, si se estimulan las mismas células con prostaglandina, se produce la misma cantidad de AMPc y, sin embargo, el músculo cardíaco apenas reacciona.
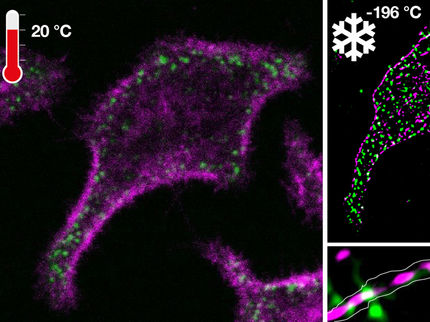
Mediante una técnica conocida como microscopía de fluorescencia, los investigadores examinaron células individuales aisladas para averiguar cómo se generan y procesan simultáneamente las señales de AMPc de dos receptores diferentes dentro de una célula. Uno de los receptores es importante para la secreción de insulina, mientras que el otro influye en la función cardíaca y pulmonar. Descubrieron que en el lugar del receptor activado se forman diminutos dominios con un radio de 30 a 60 nanómetros.
Bock compara estos nanoespacios con fábricas emergentes que se forman justo debajo de la membrana celular y se ponen a trabajar en el momento en que llega una "orden". "Cuando uno de estos nanoespacios alcanza su máxima capacidad, el AMPc se derrama en el siguiente, y así la cascada de señalización se desplaza hacia el interior de la célula", afirma.
La Dra. Charlotte Kayser explica que el descubrimiento de los nanodominios aumenta enormemente la complejidad de las vías de señalización celular. Kayser es coprimera autora del estudio, junto con la Dra. Selma Anton, antigua estudiante de doctorado en el MDC, y la Dra. Isabella Maiellaro, también antigua miembro del grupo y ahora en la Universidad de Nottingham. "Las señales que se originan en el GPCR permanecen inicialmente en el sitio local y sólo afectan a las enzimas en su vecindad inmediata", dice. "Otras regiones de la célula no se ven afectadas por ellas, lo que permite activar y desactivar las vías de señalización con gran precisión".
Los científicos han considerado durante mucho tiempo el líquido del citosol dentro de una célula como una gran "piscina" en la que todo flota libremente. Pero parece que en este líquido existen estructuras hasta ahora desconocidas -que los investigadores del MDC denominan ahora "nanoarquitectura de señalización"- que pueden activarse según las necesidades. "Todavía no podemos visualizar estos nanoespacios", dice Bock. Pero sospecha que el AMPc se mantiene dentro de los diminutos espacios gracias a una estructura similar a un gel. Podría tratarse de grandes proteínas de andamiaje, por ejemplo, o de enzimas degradadoras del AMPc que utilizan una alta concentración de AMPc para crear una frontera entre el citosol y el nanodominio.
¿Qué significa este descubrimiento para la biología celular?
Parece, por tanto, que una célula no es en realidad un interruptor que puede estar "encendido" o "apagado". El coautor e iniciador del proyecto, el profesor Martin Lohse, de ISAR Bioscience, en Múnich, explica que funciona más bien como un chip que procesa muchas señales simultáneamente en un área muy pequeña. "Esto es muy importante para las neuronas, por ejemplo, ya que les permite procesar diferentes señales en cada una de sus diversas protuberancias: un sitio puede activarse mientras otro permanece inactivo y un tercero se inhibe", afirma.
Aún no está claro qué impacto tendrá este descubrimiento en la medicina, pero Bock sospecha que abrirá un nuevo campo de investigación. Podrían desarrollarse futuros agentes terapéuticos dirigidos a componentes individuales de estas nanodominios, y así actuar con mucha más precisión o tener menos efectos secundarios.
Cuando los científicos expusieron la célula a bajas concentraciones de mensajeros, las nanodominios quedaron claramente delineados. A mayores concentraciones, los espacios empezaban a fusionarse. Esto también podría tener relevancia terapéutica: "En el caso de las sustancias que estimulan los receptores en distintos grados -como los diferentes opioides, por ejemplo-, esto podría significar que los efectos producidos diferirían no sólo cuantitativamente, sino también cualitativamente, dependiendo de si las señales de AMPc desencadenadas en la célula permanecen confinadas en las inmediaciones o abarcan toda la célula", añade Lohse. Por ahora, sin embargo, los investigadores necesitan comprender mejor cómo se construyen estas diminutas fábricas emergentes. Los primeros resultados sugieren que estas nanodominios no se forman correctamente en células enfermas, como las de cáncer de hígado y las de músculo cardíaco de pacientes con insuficiencia cardíaca.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.