Wie Proteine zueinander finden
Arrestin-Schleifen bilden Andockstellen für die Membran
Wissenschaftler der Charité – Universitätsmedizin Berlin sind der Frage nachgegangen, wie die für viele Köperfunktionen unerlässlichen Proteine GPCR und Arrestin zueinanderfinden und einen Komplex bilden. An die eintausend Formen des Membranproteins GPCR gibt es im menschlichen Körper, insbesondere an sensorischen und neuronalen Prozessen sind sie beteiligt. Die Art und Weise der Interaktion von Arrestin und GPCR hängt entscheidend vom jeweiligen Bindungsstadium ab, wie die Forscher nun in der aktuellen Ausgabe des Fachmagazins Nature Communications berichten.
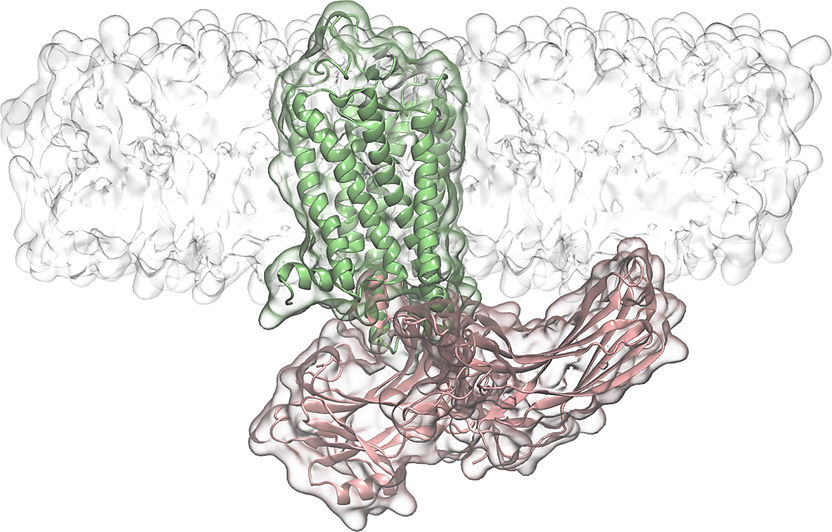
Arrestin-Schleifen als Andockstellen für die Membrane neben des Rezeptors.
Grafik: Jana Selent, Pompeu Fabra University
Fast die Hälfte aller heute verschriebenen Arzneimittel entfaltet ihre Wirkung über sogenannte G-Protein-gekoppelte Rezeptoren (GPCR). Diese Membranproteine übernehmen im gesamten Organismus die Steuerung sensorischer und physiologischer Reaktionen auf einen Reiz, beispielsweise beim Sehen und Schmecken oder bei der Regulation der Herzfrequenz. Das Protein Arrestin spielt eine Schlüsselrolle, wenn es darum geht, die Funktion und Signalgebung von GPCR in der Zelle zu kontrollieren. „GPCR sind das Ziel für breitgefächerte pharmakologischen Therapien. Daher ist es so wichtig, die Struktur und Funktionsweise der Membranproteine und ihre Interaktion auf molekularer Ebene komplett zu verstehen, um die Grundlage für bessere Medikamente mit geringeren Nebenwirkungen zu schaffen“, erklärt Dr. Martha Sommer, Leiterin der Arbeitsgruppe Arrestin am Institut für Medizinische Physik und Biophysik der Charité.
Einige Nebenwirkungen von Medikamenten, beispielsweise Morphinen, sind auf die Aktivierung eines bestimmten Arrestin-abhängigen Signalweges zurückzuführen. Durch die genaue Beobachtung des Zusammenspiels von Arrestin und GPCR konnten die Forscher nun entscheidende Rückschlüsse ziehen. „Wir haben uns gefragt, wie beide Proteine zueinander finden und was passiert, wenn sie einen Komplex bilden. Die Kristallstruktur des GPCR-Arrestin-Komplex hat uns auf die Idee gebracht, dass ein Teil des Arrestins, genannt C-edge, mit der Membran neben dem GPCR interagieren könnte“, so Dr. Sommer. „Mit Hilfe einer Kombination von Computersimulation, in Kooperation mit Dr. Jana Selent an der Universität Pompeu Fabra in Barcelona, und Biophysikalischen Methoden, wie zielgerichteten Fluoreszenz-Experimenten, konnten wir nachweisen, dass Schleifen des C-edge-Teils des Arrestins eine Verbindung mit der Membran eingehen.“ Eine solche Interaktion war bislang unbekannt und eröffnet ein neues Forschungsfeld hinsichtlich Membran und Membranfunktion. Ein tiefergehendes Verständnis des Zusammenwirkens von Arrestin und GPCR ist notwendig, um künftig noch nebenwirkungsärmere Medikamente entwickeln zu können. Das Team um Dr. Sommer ist bereits mit weiterführenden Studien zum Einfluss der Membranstruktur und Interaktionen im GPCR-Arrestin-Komplex befasst.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.