Präzisionsgenfähren: Gentransfer mit extrem hoher Selektivität
Präzisionsgenfähren für gezieltes Ansteuern von therapierelevanten Zellen nach Injektion ins Blut
Der Transfer therapeutischer Gene gilt als vielversprechender Ansatz für die erfolgreiche Behandlung von genetischen Erkrankungen und Krebs. Bisher werden hierfür dem Patienten meist vorab die Zielzellen entnommen und nach Gentransfer wieder verabreicht. Forschern des Paul-Ehrlich-Instituts ist es gemeinsam mit Kollegen aus Köln und Zürich gelungen, Gentransfer-Vehikel zu entwickeln, die im Organismus den therapierelevanten Zelltyp ansteuern und ein therapeutisches Gen übertragen. Dabei erfolgt der Gentransfer mit extrem hoher Selektivität. Über die Forschungsergebnisse berichtet Nature Communications in seiner Online-Ausgabe vom 10.02.2015.
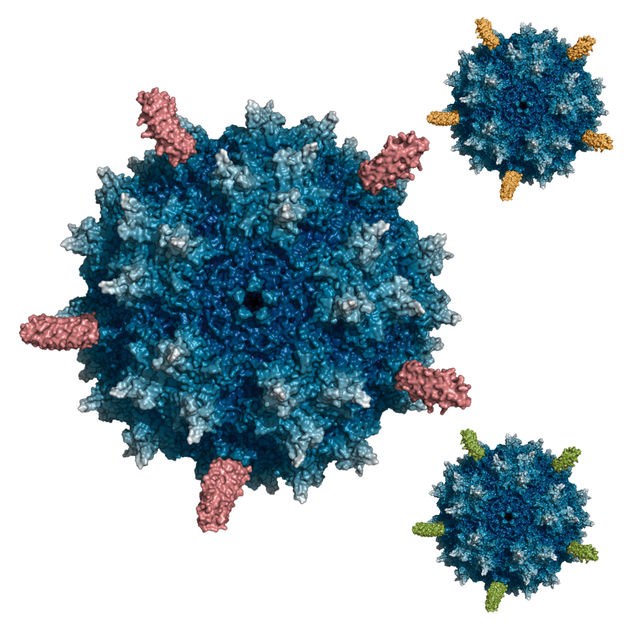
AAV-Präzisionsgenfähren: Die Rezeptor-bindenden Zielstrukturen (DARPins) sind rot, gelb oder grün dargestellt. Durch sie können die Genfähren therapierelevante Zellen im Körper ansteuern.
Paul-Ehrlich-Institut (PEI)
Als Transportmittel für den gezielten Gentransfer verwendeten die Forscher um Prof. Christian J. Buchholz, Projektleiter im LOEWE Zentrum für Zell- und Gentherapie Frankfurt und Leiter der Arbeitsgruppe „Molekulare Biotechnologie und Gentherapie“ des Präsidenten des Paul-Ehrlich-Instituts, vom Adeno-assoziierten Virus (AAV) abgeleitete Vektoren. AAV ist ein nicht pathogenes Parvovirus. Das einzige bisher in Europa zugelassene Gentherapeutikum zur Behandlung einer seltenen Stoffwechselkrankheit basiert ebenfalls auf AAV-Genfähren.
Das Konzept zur Erzeugung der neuen Präzisionsgenfähren wurde gemeinsam mit PD Dr. Hildegard Büning, Leiterin der Arbeitsgruppe „AAV Vektorentwicklung“ am ZMMK der Universität zu Köln, entwickelt und umgesetzt: Durch Austausch zweier Aminosäuren des AAV nahmen die Forscher dem Virus die Fähigkeit, an seinen natürlichen Rezeptor zu binden und so die Möglichkeit, in eine große Bandbreite unterschiedlichster Zelltypen einzudringen. Dann wurden Zielstrukturen (DARPins, designed ankyrin repeat proteins), die an der Universität Zürich entwickelt worden waren, an die Oberfläche der modifizierten Vektorpartikel angehängt. Diese können nun so gewählt werden, dass sie die Vektorpartikel an Zellrezeptoren binden, die nur auf einem therapierelevanten Zelltyp vorhanden sind. So wird das Andocken und Eindringen des AAV-Vektors in die gewünschte Zielzelle ermöglicht. In der vorliegenden Arbeit wurden DARPins mit hoher Spezifität für die Tumorantigene Her2/neu, das bei Brustkrebs eine wesentliche Rolle spielt, und EpCAM, ein epitheliales Oberflächenprotein, sowie Marker bestimmter Blutzellen (CD4 auf der Oberfläche von Lymphozyten mit bestimmter immunologischer Funktion) verwendet.
Im Mausmodell traf der Vektor für Her2/neu bereits nach einmaliger Injektion 80 Prozent aller Tumormetastasen. Wurde mit dem Vektor ein zelltötendes Gen gezielt in die Tumorzellen eingeschleust, war die Überlebensrate der Mäuse deutlich besser als nach Gabe eines zugelassenen Tumormedikaments. Mit dem Vektor gegen EpCAM ließen sich Tumorzellen in humanem Blut hochsensitiv detektieren (wenige hundert Tumorzellen in mehreren Millilitern Blut).
Und auch der Vektor, der auf Blutzellen ausgerichtet wurde, traf sein Ziel: Nur an Lymphozyten in der Milz, die tatsächlich das CD4-Protein und damit die Zielstruktur trugen, dockte AAV an und übertrug das Gen.
„Das von uns gemeinsam entwickelte Verfahren ist sowohl für die Grundlagenforschung als auch für den gezielten Gentransfer in der Medizin ein vielversprechendes Werkzeug“, erläutert Buchholz die aktuellen Forschungsergebnisse.
Originalveröffentlichung
Münch RC, Muth A, Muik A, Friedel T, Schmatz J, Dreier B, Trkola A, Plückthun A, Büning H, Buchholz CJ (2015): Off-target-free gene delivery by affinity-purified receptor-targeted viral vectors. Nat Commun Feb 10