Relikte aus grauer Vorzeit als Angriffspunkt für Impfung gegen Krebs
Forschern des Paul-Ehrlich-Instituts ist es gelungen, eine Besonderheit von Krebszellen für einen gezielten immunologischen Angriff zu nutzen: Während endogene Retroviren bei gesunden Zellen inaktiv sind, produzieren Krebszellen Proteine dieser Viren. Mit einem Impfstoff, der gegen diese endogenen Retroviren gerichtet ist, gelang es, bei Mäusen das Fortschreiten des Tumorwachstums deutlich zu bremsen. Durch prophylaktische Impfung ließ sich sogar die Entstehung des Tumors verhindern. Über die Forschungsergebnisse berichtet PLoS ONE.
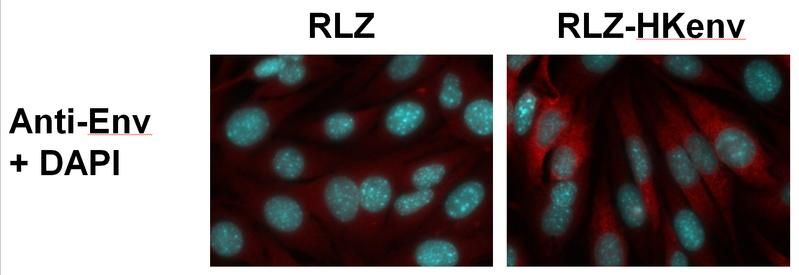
Zellen der Mäuse-Nierenkrebszelllinie Renca. Links: ohne HERV-K-Hüllprotein-Produktion. Rechts: genetisch veränderte Renca-Zellen mit HERV-K-Hüllprotein (in rot).
PEI
Humane endogene Retroviren (HERV) sind vor langer Zeit in die menschliche Keimbahn geraten und werden von Generation zu Generation weitergegeben. Das menschliche Genom enthält mehrere Tausend endogene Retroviren. In der Regel verhalten sich die Gene der HERV stumm, werden also nicht exprimiert und in Proteine übersetzt. Forscher des Paul-Ehrlich-Instituts und andere Arbeitsgruppen hatten bereits zeigen können, dass es bei HIV-Patienten, aber auch bei verschiedenen Krebserkrankungen in den Tumorzellen verstärkt zur Expression der Gene einer Gruppe dieser Retroviren kommt. Die HERV-Gruppe konnte als "HERV-K/HML-2(hom)" (abgekürzt HERV-K) identifiziert werden.
PEI-Forscher in der Abteilung Virologie um Barbara Schnierle wollten nun wissen, ob sich die spezifische Genaktivität der HERV-K in Tumorzellen therapeutisch nutzen lässt, um gezielt Krebszellen zu bekämpfen. Um normale Zellen zu schonen, ist es notwendig, Strukturen bzw. Angriffspunkte ausfindig zu machen, die nur die Krebszellen aufweisen. Für ihre Untersuchungen verwendeten die Wissenschaftler um Prof. Barbara Schnierle, Leiterin der Forschungsgruppe "AIDS, Neue und neuartige Erreger" eine Mäuse-Nierenkrebszelllinie (Renca). Diese Zelllinie war genetisch so verändert worden, dass die Zellen das (menschliche) HERV-K-Hüllprotein bildeten, um so der Situation bei HERV-positiven menschlichen Krebszellen möglichst nahe zu kommen. Mäuse, denen diese Zellen intravenös appliziert wurden, entwickelten nach kurzer Zeit Lungenmetastasen.
Zur "Impfung" gegen diese Tumoren nutzten die Forscher das modifizierte Vacciniavirus Ankara (MVA) als abgewandeltes Impfvirus, das sich nicht vermehren kann. In das MVA-Erbgut hatten Schnierle und Kollegen das Gen für das HERV-K-Hüllprotein eingebaut. Nach der Impfung wird das Gen in Zellen abgelesen und das Hüllprotein gebildet. Es wird dem Immunsystem als Antigen präsentiert, wodurch es zu einer Immunreaktion kommt.
Die PEI-Forscher prüften die Anwendbarkeit ihres "Impfstoffs" sowohl im Hinblick auf eine therapeutische als auch eine prophylaktische Vakzinierung: Für den therapeutischen Ansatz applizierten sie zunächst die genetisch veränderten Nierenkrebszellen, warteten zehn Tage, bis sich die Lungenmetastasen gebildet hatten und behandelten einen Teil der Mäuse mit dem MVA-Impfstoff. Bei den geimpften Tieren wuchsen die Tumoren deutlich langsamer und die Anzahl der Metastasen war geringer als bei den nicht geimpften Tieren. Eine vollständige Rückbildung des Tumors gelang allerdings nicht.
Bei der prophylaktischen Impfung fiel der Effekt noch stärker aus: Hier wurden die Tiere zunächst zweimal mit dem Virus geimpft (Tag 0 und 21) und erst zwölf Tage später die Krebszellen appliziert. Die geimpften Tiere waren vollständig vor einer Tumorbildung geschützt – es waren keine Metastasen nachweisbar.



















































