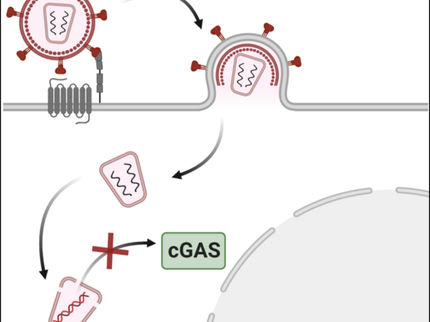
Los científicos descubren la función de un misterioso componente del VIH
Los investigadores descubren cómo madura la capa matriz del VIH-1
Investigadores del Instituto Max Planck de Bioquímica han descubierto el mecanismo que subyace a un importante paso en el ciclo vital del VIH. En colaboración con equipos de las universidades de Heidelberg y Yale, descubrieron que el enigmático "péptido espaciador 2", uno de los componentes del virus, desempeña un papel clave en la conversión de partículas inmaduras del VIH-1 en partículas infecciosas. Los resultados del estudio se publicaron en la revista Nature.
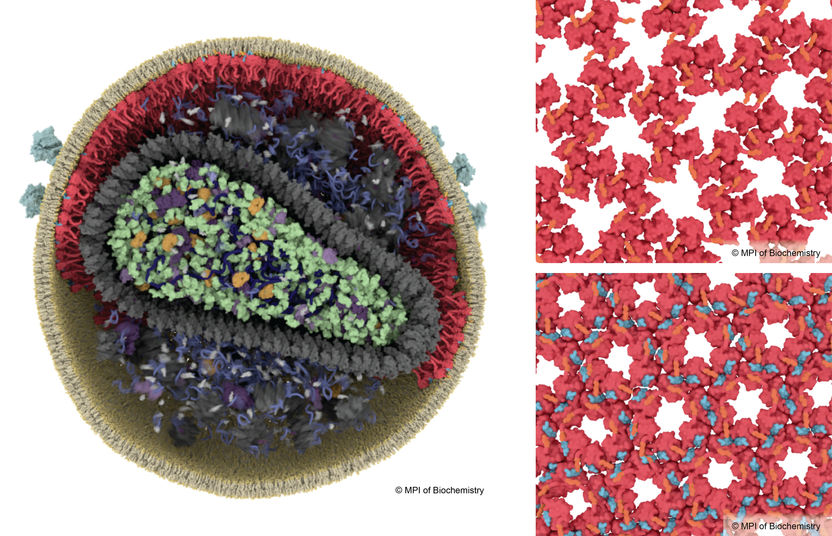
Para volverse infeccioso, el VIH tiene que someterse a un proceso de maduración, que implica una reorganización de las proteínas de la matriz (rojo). En una partícula inmadura del virus, las proteínas de la matriz forman un entramado perdido (arriba a la derecha), mientras que en un VIH maduro, la formación de un entramado nuevo y estable se desencadena por la unión de la proteína péptido espaciador 2 (azul, abajo a la derecha).
Margot Riggi, MPI of Biochemistry
Las partículas del VIH-1 se liberan de las células infectadas en una forma inmadura, no infecciosa. El principal material de construcción de una partícula vírica son unas 2.000 copias de una proteína larga en forma de varilla llamada Gag. Para convertirse en infeccioso, el VIH tiene que someterse a un proceso de maduración. En él interviene la proteasa del VIH-1 (una enzima vírica), que corta la Gag en seis proteínas más pequeñas, incluidas la proteína de la cápside y la proteína de la matriz. Esto provoca una enorme reorganización estructural de los componentes del virus.
Durante muchos años, los científicos han estudiado los cambios estructurales de la cápside del virus, que contiene el genoma. En cambio, se sabe mucho menos sobre la matriz del virus, la cubierta proteínica exterior situada directamente debajo de la membrana lipídica que envuelve al virus. Investigadores dirigidos por John Briggs, director y biólogo estructural del Instituto Max Planck de Bioquímica, han descubierto cómo se reorganiza la proteína de la matriz durante la maduración de la partícula infecciosa.
Utilizaron los microscopios crioelectrónicos más avanzados para obtener imágenes de las partículas víricas y, a continuación, recurrieron al análisis computacional de imágenes para obtener modelos tridimensionales muy detallados de las proteínas víricas. Inesperadamente, descubrieron que la reordenación de la matriz es desencadenada por el "péptido espaciador 2", que se adhiere a la matriz y hace que se empaquete de forma diferente. El péptido espaciador 2 es otro de los seis componentes que se forman al cortar Gag, pero su función era desconocida hasta ahora. La unión del péptido espaciador 2 a la proteína de la matriz permite al virus fusionarse más rápidamente con las células diana. El trabajo se ha realizado en colaboración con socios de la Universidad de Heidelberg y la Universidad de Yale (EE.UU.).
John Briggs explica: "En nuestro laboratorio obtuvimos los primeros datos estructurales sobre la matriz en 2021, pero no sabíamos qué hacía que se reorganizara cuando el virus madura. En este nuevo estudio obtuvimos vistas en 3D mucho más detalladas de la capa de la matriz, eso fue clave para entender lo que está pasando."
James Stacey y Dominik Hrebík, los dos primeros autores del estudio, explican sus hallazgos. James afirma: "La matriz del virus tiene un bolsillo en su forma madura. Sabíamos que allí se une algo, pero pensábamos que era un lípido de la membrana. Ahora vemos que se trata del péptido espaciador 2. Nos preguntamos si este bolsillo podría ser una diana para moléculas farmacológicas en el futuro". Dominik afirma: "Hasta ahora se desconocía la función del péptido espaciador 2. Gracias a la criomicroscopía electrónica de alta resolución, hemos visto que este péptido, tras su liberación, se une directamente a las proteínas de la matriz y enlaza las proteínas entre sí en el virus maduro."
John Briggs resume: "El VIH-1 es probablemente el virus más estudiado, pero todavía hay pasos importantes en su replicación que aún no comprendemos".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
James C. V. Stacey, Dominik Hrebík, Elizabeth Nand, Snehith Dyavari Shetty, Kun Qu, Marius Boicu, Maria Anders-Össwein, Pradeep D. Uchil, Robert A. Dick, Walther Mothes, Hans-Georg Kräusslich, Barbara Müller, John A. G. Briggs; "The conserved HIV-1 spacer peptide 2 triggers matrix lattice maturation"; Nature, 2025-2-26