El estado epigenético determina la metástasis
"Estos resultados son sorprendentes y podrían tener consecuencias de gran alcance para el diagnóstico y la terapia de tumores"
Científicos del Centro Alemán de Investigación Oncológica (DKFZ) y de la Facultad de Medicina de Mannheim de la Universidad de Heidelberg investigaron en ratones cómo se comportan las células tumorales que se extienden en el lugar de la metástasis: Algunas células tumorales comienzan inmediatamente a formar metástasis. Otras abandonan el vaso sanguíneo y pueden entrar en un largo periodo de latencia. Lo que determina qué camino toman las células cancerosas es su estado epigenético. Esto también se confirmó en experimentos con células tumorales humanas. Los resultados del estudio podrían abrir el camino a nuevas aplicaciones diagnósticas y terapéuticas.

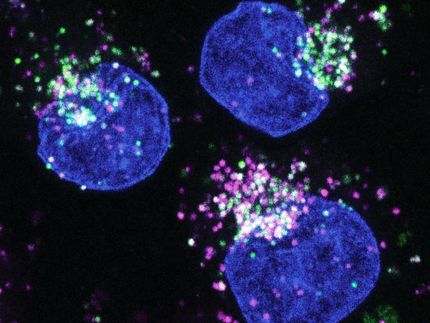
Células tumorales metastatizantes parcialmente extravasadas (rosa) que salen de la circulación pulmonar (blanco).
© Augustin/DKFZ
¿Por qué es tan peligroso el cáncer? Las células cancerosas que abandonan el tumor primario para llegar a lugares distantes del cuerpo donde pueden crecer y convertirse en tumores hijos, llamados metástasis. Aunque la mayoría de los tumores primarios pueden tratarse eficazmente, las metástasis son el verdadero peligro. Los oncólogos calculan que más del 90% de todas las muertes por cáncer en tumores sólidos se deben a metástasis.
Los investigadores llevan décadas trabajando para comprender y prevenir la propagación de las células tumorales. Sin embargo, aún se desconocen en gran medida los mecanismos que permiten que una célula cancerosa sobreviva en un órgano distante y acabe creciendo hasta convertirse en una metástasis.
Para propagarse por el organismo, las células cancerosas viajan a través de la sangre y el sistema linfático. Científicos del DKFZ y de la Universidad de Heidelberg han desarrollado ahora un método para observar en ratones el comportamiento de las células cancerosas que migran inmediatamente después de llegar al órgano metastásico, en este caso el pulmón.
El equipo dirigido por los dos primeros autores, Moritz Jakab y Ki Hong Lee, descubrió que algunas células tumorales, una vez que han llegado al órgano metastásico, abandonan el vaso sanguíneo y entran en un estado de reposo. Otras células cancerosas comienzan a dividirse directamente dentro del vaso sanguíneo y crecen hasta convertirse en metástasis.
Esta delicada decisión sobre el destino de las células tumorales metastásicas está controlada por las células endoteliales que recubren el interior de todos los vasos sanguíneos. Éstas liberan factores de la vía de señalización Wnt que favorecen la salida de las células tumorales del vaso sanguíneo e inician así la latencia. Cuando los investigadores desactivaron los factores Wnt, la latencia dejó de producirse.
¿Qué distingue a las células cancerosas latentes de las que crecen y metastatizan?
"Llegados a este punto, nos planteamos la siguiente pregunta: ¿Por qué algunas células cancerosas forman inmediatamente una metástasis, mientras que otras caen en una especie de letargo?", explica Moritz Jakab. Las células cancerosas durmientes y metastásicas no diferían genéticamente, ni en muchos otros aspectos moleculares. Pero los investigadores pudieron detectar una sutil diferencia: La metilación del ADN difería entre los dos tipos celulares. Las células tumorales, cuyo ADN estaba menos metilado, respondían de forma más sensible a los factores Wnt, lo que provocaba su extravasación del vaso sanguíneo y su posterior latencia. Por otro lado, las células cancerosas más metiladas no respondían a los factores Wnt, permanecían en el vaso sanguíneo e iniciaban inmediatamente el crecimiento metastásico.
La metilación del ADN forma parte de la memoria epigenética que se transmite a las células hijas durante la división celular. Por tanto, el estado de metilación de una célula es en gran medida estable. Esto llevó a los investigadores a sospechar que el comportamiento metastásico de las células cancerosas podría estar ya determinado cuando se desprenden del tumor primario.
Para probar esta hipótesis, el equipo examinó el estado de metilación del ADN de varias líneas celulares tumorales. De hecho, descubrieron que éste se correlacionaba directamente con su potencial metastásico.
"Estos resultados son sorprendentes y podrían tener consecuencias de gran alcance para el diagnóstico y la terapia de tumores. Los resultados del estudio podrían, por ejemplo, ayudar a utilizar determinados patrones de metilación como biomarcadores para predecir en los pacientes el nivel de carga de células cancerosas latentes y, por tanto, la probabilidad de que el paciente recaiga tras un tratamiento exitoso del tumor primario", afirma el autor principal, Hellmut Augustin. "Pero primero tenemos que estudiar si los tumores humanos naturales se comportan de la misma manera que las líneas celulares empleadas o los tumores experimentales".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.