Bactericida fotosensible
Un nanomaterial con "interruptor de luz" mata bacterias Gram negativas o Gram positivas
Las infecciones asociadas a la asistencia sanitaria son un problema habitual en el cuidado de heridas supurantes, al igual que el aumento de bacterias multirresistentes. Para combatir eficaz y selectivamente las infecciones bacterianas, un equipo de investigadores ha desarrollado un nanomaterial bactericida dotado de un "interruptor de luz" fotoquímico que puede dirigirse contra bacterias Gram-positivas o Gram-negativas. Según informa el equipo en su estudio publicado en Angewandte Chemie, su eficacia contra el SARM puede extenderse a otras infecciones bacterianas selectivas.
© Wiley-VCH
Las infecciones resistentes a los antibióticos se han convertido en un problema urgente de salud pública, sobre todo en el ámbito hospitalario. Muchas de las especies bacterianas en cuestión están muy extendidas en la naturaleza, pero pueden causar infecciones mucho más graves, a veces intratables, en pacientes inmunodeprimidos. Los materiales bactericidas ofrecen un nuevo enfoque para combatir las infecciones asociadas a la asistencia sanitaria que no depende de los antibióticos. Mrinmoy De y sus colegas del Instituto Indio de Ciencias de Bengaluru (India) han logrado producir un nanomaterial sensible a la luz ultravioleta que puede activarse para atacar bacterias Gram positivas o Gram negativas.
Ambos tipos de bacterias tienen estructuras de membrana externa y composición muy diferentes. Las bacterias grampositivas, como el Staphylococcus aureus resistente a la meticilina (SARM), tienen una membrana bacteriana compuesta principalmente de peptidoglicanos. En cambio, las bacterias Gram negativas, como Pseudomonas aeruginosa, otra bacteria asociada a la asistencia sanitaria con una problemática resistencia a los antibióticos de banda ancha, tienen una membrana interna y externa compuesta principalmente de fosfolípidos con una fina capa de peptidoglicanos. "Es importante lograr una actividad bactericida selectiva por cepa", afirma De.
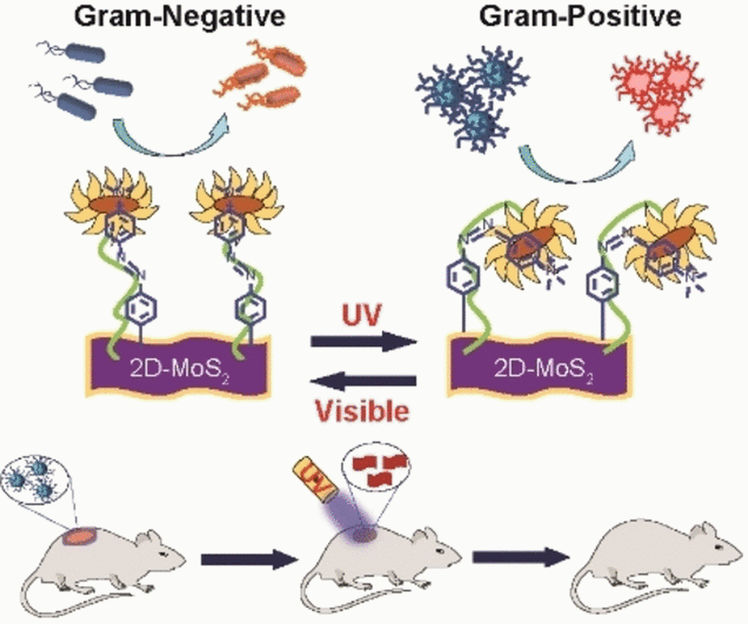
Para conseguir un agente bactericida que pudiera interactuar selectivamente con ambas superficies químicas, el equipo diseñó un nanomaterial funcionalizado hecho de disulfuro de molibdeno (MoS2) con restos de azobenceno a los que se unieron grupos amino cuaternarios cargados positivamente. Mientras que el MoS2 es un bactericida y los grupos amino cuaternarios permiten la despolarización de la membrana, las moléculas de azobenceno introducen un cambio en la nanoestructura impulsado por la luz, pasando de una forma alargada trans a una curvada cis para crear interacciones superficiales selectivas.
El equipo utilizó varias sondas químicas y mediciones ópticas para determinar que tanto la forma cis como la trans del nanomaterial mataban a las bacterias, aunque de formas muy diferentes. En el caso de la bacteria Gram-negativa P. aeruginosa, la forma trans despolarizó la membrana bacteriana y la perforó por completo. Esto permitió al nanomaterial MoS2 generar especies reactivas de oxígeno intracelular y matar a la bacteria. Por el contrario, la cepa Gram-positiva MRSA respondió más eficazmente a la forma cis. En este caso, la pared celular resultó dañada y rota por interacciones específicas.
Simplemente "cambiando" el interruptor UV del estado básico trans al estado cis, el equipo pudo controlar la selectividad para cualquiera de los dos tipos de bacterias. Demostraron la eficacia de su nanomaterial curando con éxito heridas infectadas por SARM en modelos de ratón. Las heridas se cerraron completamente al cabo de 10 días cuando se trataron con el reactivo cis, mientras que el tratamiento antibiótico habitual con vancomicina no curaba con rapidez.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.