El metabolismo se une a la señalización para ajustar el crecimiento celular
El metabolito endógeno inhibe directamente la actividad de mTORC1
Las células utilizan diversas vías metabólicas para sintetizar los componentes básicos del crecimiento y la proliferación. Para garantizar un crecimiento equilibrado, estos procesos biosintéticos deben estar estrechamente coordinados. Investigadores del Instituto Max Planck de Biología del Envejecimiento, junto con un equipo de colaboradores nacionales e internacionales, han identificado ahora una maquinaria molecular que detecta la capacidad de una célula para fabricar lípidos y, en consecuencia, bloquear o activar todos los demás procesos biosintéticos, como la síntesis de proteínas.
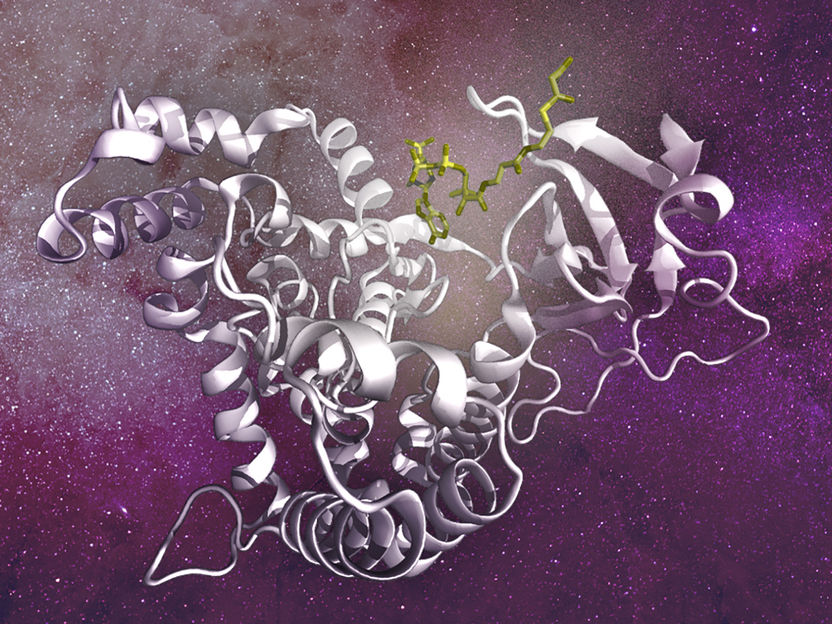
El metabolito malonil CoA se une directamente al bolsillo catalítico de mTOR y desplaza al ATP, otro metabolito necesario para la actividad de mTOR.
©K. Link / Max Planck Institute for Biology of Ageing
Las células acumulan masa y crecen utilizando nutrientes y energía para construir membranas, proteínas, ácidos nucleicos y otras estructuras macromoleculares, mediante la acción coordinada de diversas vías metabólicas. Por lo tanto, los mecanismos de detección de nutrientes garantizan que las células sólo crezcan cuando todas las condiciones son óptimas. El sensor de nutrientes más importante de las células es un complejo proteico denominado mTORC1. Cuando los aminoácidos, los componentes básicos de las proteínas, son abundantes, mTORC1 se activa y promueve la síntesis de proteínas, vinculando así la disponibilidad de aminoácidos a la función celular correspondiente. Sin embargo, no se sabe muy bien cómo se detecta la capacidad de las células para producir lípidos y si mTORC1 interviene en este proceso.
En la biosíntesis de los ácidos grasos, el acetil-CoA, un metabolito procedente principalmente de la descomposición de la glucosa (otro nutriente importante), se convierte primero en malonil-CoA mediante una enzima llamada ACC1, que a su vez se convierte en ácidos grasos mediante una enzima llamada FASN (sintasa de ácidos grasos). Los investigadores demostraron que la acumulación de malonil-CoA, que puede producirse cuando los niveles o la actividad de FASN son bajos, provoca la inhibición de la actividad de mTORC1 y la regulación a la baja de otras funciones biosintéticas reguladas por mTORC1, como la síntesis de proteínas. Sorprendentemente, descubrieron que el malonil-CoA se une directamente al bolsillo catalítico de mTOR, compitiendo con el ATP, otro metabolito necesario para que mTOR esté activo y fosforile sus sustratos.
"Estos hallazgos ponen de relieve que el malonil-CoA es el primer metabolito endógeno descrito que actúa como inhibidor competitivo del ATP para una cinasa de señalización en células de mamífero", afirma Constantinos Demetriades, jefe del grupo de investigación del Instituto Max Planck de Biología del Envejecimiento y responsable del estudio. "Cabe destacar que este fenómeno se conserva evolutivamente desde la levadura hasta las células humanas, por lo que representa un antiguo mecanismo a través del cual el metabolismo lipídico habla con el regulador central de todos los demás procesos metabólicos, mTORC1".
Vinculación de la biosíntesis de ácidos grasos con el crecimiento celular a través de mTORC1
A nivel molecular, los investigadores descubrieron que mTORC1 forma interacciones físicas con ACC1 y FASN, lo que le permite detectar directamente los niveles de malonil-CoA en el lugar donde se produce el metabolito. De este modo, la unión directa del malonil-CoA al mTORC1 desactiva todos los demás procesos celulares que se controlan a partir de este complejo. Como resultado, en condiciones en las que una célula no puede producir suficientes ácidos grasos, la inhibición de mTORC1 también bloquearía la síntesis de proteínas, otros procesos anabólicos y, finalmente, el crecimiento celular, hasta que las condiciones vuelvan a ser óptimas.
Dado que los inhibidores farmacológicos de FASN, como los utilizados en este estudio, se emplean como fármacos anticancerígenos en la clínica, estos descubrimientos también pueden ser relevantes para el tratamiento del cáncer en el futuro. Según los datos aquí descritos, es probable que los inhibidores de FASN tengan un doble efecto en las células cancerosas: no sólo bloquean la síntesis de ácidos grasos, necesaria para la formación de membranas y la producción de energía, sino que también inhiben la actividad de mTORC1, que está desregulada en la mayoría de los cánceres.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Raffaele Nicastro, Laura Brohée, Josephine Alba, Julian Nüchel, Gianluca Figlia, Stefanie Kipschull, Peter Gollwitzer, Jesus Romero-Pozuelo, Stephanie A. Fernandes, Andreas Lamprakis, Stefano Vanni, Aurelio A. Telemann, Claudio De Virgilio, Constantinos Demetriades; "Malonyl-CoA is a conserved endogenous ATP-competitive mTORC1 inhibitor"; Nature Cell Biology.