La proteína "Moonlighting" hace dañino a un germen hospitalario
Un equipo de investigadores descubre un posible enfoque para nuevas terapias contra las infecciones por Pseudomonas aeruginosa
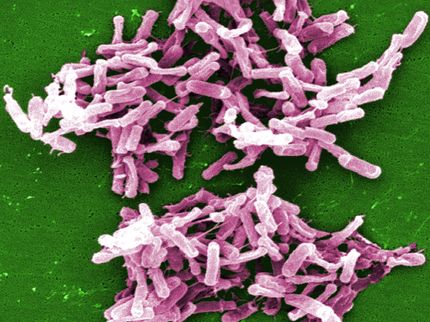
La bacteria Pseudomonas aeruginosa es un germen hospitalario muy extendido y peligroso. Infecta las vías respiratorias y los pulmones y posee una resistencia natural a numerosos antibióticos. Se están buscando los llamados patobloqueantes para poder combatir mejor la bacteria en el futuro. No se trata de matar al patógeno, como en el caso de los antibióticos, sino de eliminar o reducir su efecto patógeno. En una infección por Pseudomonas aeruginosa, el producto metabólico verde azulado piocianina, entre otros factores, contribuye a la aparición de procesos inflamatorios y tiene un efecto dañino sobre los tejidos. La infección sería menos grave si se pudiera impedir la producción de esta sustancia mediante un patobloqueante. Pero para ello, primero hay que conocer los mecanismos moleculares exactos responsables de la producción de piocianina dentro de la célula bacteriana. El equipo de investigación dirigido por el profesor Wulf Blankenfeldt, jefe del departamento "Estructura y función de las proteínas" del Centro Helmholtz para la Investigación de infecciones (HZI) de Braunschweig, descubrió recientemente más detalles de la interacción de proteínas necesaria para la producción de piocianina aplicando modernos métodos de análisis bioquímico de proteínas. En el curso de este trabajo, ha podido aclarar la función central de una proteína llamada PqsE como "pluriempleada" en este proceso. El estudio se publica en el número actual de Nature Communications.
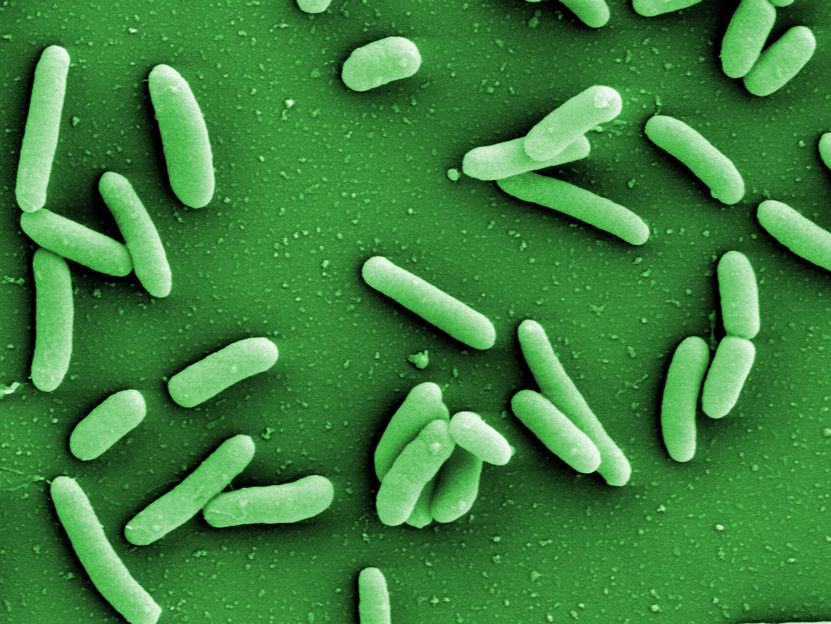
Pseudomonas aeruginosa
HZI/Manfred Rohde
En nuestra entrevista, Wulf Blankenfeldt explica qué hace tan peligrosa a la bacteria Pseudomonas aeruginosa, por qué nunca ha perdido el interés por la función de PqsE durante más de dos décadas y cómo ha podido informar sobre el pluriempleo de esta proteína.
Profesor Blankenfeldt, ¿dónde puede uno infectarse con Pseudomonas aeruginosa y quién corre un riesgo especial?
Wulf Blankenfeldt: Este patógeno bacteriano tan extendido puede infectarse casi en cualquier sitio. Le gustan los ambientes húmedos, y hay bastantes lugares en los que puede estar presente: por ejemplo, en el suelo o en el agua al aire libre. Pero también se siente como en casa en el agua del grifo, lavabos, lavavajillas, duchas o inodoros, cualquier lugar en el que es fácil infectarse si las medidas de higiene no son perfectas al 100%. Y también es transmisible de una persona a otra. Para las personas con un sistema inmunitario debilitado o enfermedades respiratorias graves, como la fibrosis quística o la enfermedad pulmonar obstructiva crónica (EPOC), una infección puede resultar muy peligrosa y a veces incluso poner en peligro la vida. Por desgracia, la Pseudomonas aeruginosa también se ha hecho un nombre como germen hospitalario.
¿Por qué muchos antibióticos son ineficaces contra este germen?
Pseudomonas aeruginosa puede expulsar selectivamente del interior de su célula sustancias extrañas, como fármacos, y es una de las bacterias que forman la llamada biopelícula. Estas bacterias se rodean de una especie de capa mucosa que les ofrece cierto grado de protección, por ejemplo contra los antibióticos. Esto hace que Pseudomonas aeruginosa sea naturalmente resistente a un gran número de antibióticos y, por tanto, difícil de combatir. El desarrollo de patobloqueantes eficaces que pudieran frenar o eliminar la influencia del patógeno sería una gran ayuda en este caso.
Sería beneficioso desactivar el producto metabólico piocianina, que produce el patógeno y daña los tejidos. ¿Qué papel desempeñan las proteínas investigadas en su estudio?
La piocianina sólo se produce tras la lectura de los genes necesarios para su producción. Y este proceso de lectura está controlado por una interacción de diferentes proteínas. En el centro de este proceso se encuentra una proteína llamada RhlR. Desde hace tiempo se sabe que RhlR sólo inicia la lectura de los genes cuando la molécula señal C4-HSL da el visto bueno y se une a RhlR. Pero hasta ahora no se sabía bien si en esta cascada de señalización podían intervenir otras proteínas y, sobre todo, cómo.
Pero usted ya tenía un sospechoso en el punto de mira...
(Risas) Exacto, ¡incluso un sospechoso a largo plazo! Hace unos 20 años, mi equipo y yo empezamos a trabajar en una proteína llamada PqsE, que se creía asociada a la producción de piocianina. En aquella época, pudimos dilucidar su estructura cristalina, entre otras cosas. Y luego, hace unos cinco años, obtuvimos las primeras pruebas en estudios de laboratorio de que la proteína RhlR, intrínsecamente bastante inestable, se estabiliza al unirse a PqsE. Desde entonces, para mí era obvio que PqsE también podría estar directamente implicada en la activación de los genes de la piocianina, pero aún no podía demostrarlo.
Ahora lo ha conseguido, como demuestra su reciente estudio en Nature Communications.
Sí, ¡por fin! Con la ayuda de métodos informáticos muy sofisticados desarrollados recientemente. Esto no habría sido posible en el pasado. Utilizamos un programa informático israelí para diseñar en el ordenador una proteína RhlR artificial que fuera estable por sí misma y conservara toda su función en la lectura de genes. A continuación, obtuvimos el plano de ADN para que lo produjera una empresa y, posteriormente, examinamos la proteína artificial en nuestro laboratorio. En nuestro estudio, comprobamos si la RhlR sintética estabilizada es capaz de iniciar la lectura de genes para la producción de piocianina incluso en ausencia de PqsE. Y he aquí que ¡Ese fue exactamente el caso! Por otra parte, en experimentos comparativos, el RhlR natural fue incapaz de leer los genes en ausencia de PqsE, y no se produjo piocianina. Así pues, pudimos demostrar que se requiere un RhlR estable para el proceso de lectura, y que la proteína PqsE es responsable de ello al asociarse con el RhlR para formar un complejo.
Sin embargo, PqsE les había llevado a usted y a sus colegas de investigación internacionales por el camino del jardín...
Sí, ¡así es! PqsE se había clasificado en el grupo de las llamadas tioesterasas basándose en sus propiedades como enzima, que son proteínas que aceleran procesos (bio)químicos. Por lo tanto, se suponía que sus actividades como enzima también entrarían en juego de alguna manera con respecto a la piocianina. Pero el efecto estabilizador que ejerce PqsE sobre RhlR no tiene nada que ver con su actividad como enzima. En realidad, PqsE nos ha llevado por el camino del jardín durante mucho tiempo. Pero, afortunadamente, ahora hemos podido informar oficialmente de su pluriempleo como estabilizador de RhlR, e incluso es posible que podamos detenerlo en el futuro.
¿Hacia dónde se dirigen ahora? ¿Las proteínas de Pseudomonas aeruginosa seguirán manteniéndoles ocupados?
Por supuesto. No me han dejado ir en veinte años, y supongo que habrá muchos más años por venir, y ahora se está poniendo realmente emocionante. Con métodos modernos como la cristalografía de proteínas, en nuestro estudio pudimos visualizar el complejo proteico RhlR-PqsE en 3D. Se trata de una base excelente para buscar, junto con nuestros colegas del HZI, sustancias activas que interfieran específicamente en esta interacción y puedan utilizarse como patobloqueantes. Ya estamos trabajando en un procedimiento de cribado y esperamos que nuestras futuras investigaciones sigan contribuyendo a la identificación de enfoques terapéuticos novedosos que puedan aplicarse con éxito en las infecciones por Pseudomonas".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Sebastian Roman Borgert, Steffi Henke, Florian Witzgall, Stefan Schmelz, Susanne zur Lage, Sven-Kevin Hotop, Steffi Stephen, Dennis Lübken, Jonas Krüger, Nicolas Oswaldo Gomez, Marco van Ham, Lothar Jänsch, Markus Kalesse, Andreas Pich, Mark Brönstrup, Susanne Häussler & Wulf Blankenfeldt: Moonlighting chaperone activity of the enzyme PqsE contributes to RhlR-controlled virulence of Pseudomonas aeruginosa. Nature Communications 2022