Cómo los parásitos mortales se 'deslizan' hacia el humano cells
El análisis de rayos X revela la estructura de la maquinaria molecular de los patógenos de la malaria y la toxoplasmosis
Una investigación en la fuente de rayos X de DESY PETRA III proporciona nuevos conocimientos sobre la maquinaria molecular por la que ciertos parásitos viajan a través del organismo humano. El estudio, dirigido por Christian Löw de la rama de Hamburgo del Laboratorio Europeo de Biología Molecular EMBL, analizó el llamado movimiento de deslizamiento de los parásitos de la malaria y la toxoplasmosis. Los resultados, que el equipo interdisciplinario presenta en la revista Communications Biology, pueden ayudar en la búsqueda de nuevos fármacos contra los patógenos.
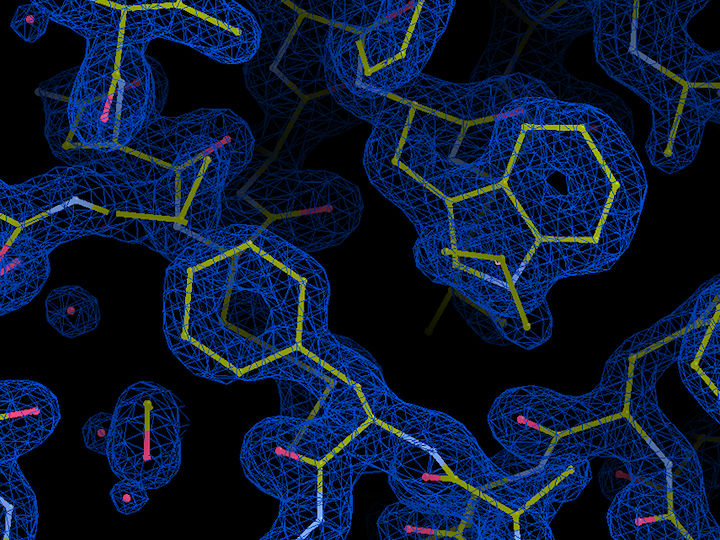
Estructura molecular de la proteína de cadena ligera esencial (ELC) en el glideosoma del Plasmodium. El azul representa la densidad electrónica de la proteína, con enlaces entre los átomos indicados en amarillo y las moléculas de agua indicadas en rojo. La estructura cristalina a una resolución de 1,5 Ångström (0,15 millonésimas de milímetro) se obtuvo en las líneas de haz del EMBL en la fuente de rayos X de DESY, PETRA III.
EMBL, Samuel Pazicky
En términos biológicos, el deslizamiento se refiere al tipo de movimiento durante el cual una célula se mueve a lo largo de una superficie sin cambiar su forma. Esta forma de movimiento es exclusiva de los parásitos del filo Apicomplexa, como el Plasmodium y el Toxoplasma. Ambos parásitos, que son transmitidos por mosquitos y gatos, tienen un enorme impacto en la salud global. El Plasmodium causa 228 millones de infecciones de paludismo y alrededor de 400 000 muertes por año. El Toxoplasma, que infecta incluso a un tercio de la población humana, puede causar síntomas graves en algunas personas, y es particularmente peligroso durante el embarazo.
El deslizamiento permite a los parásitos de Apicomplexa entrar y moverse entre las células huéspedes. Por ejemplo, al entrar en el cuerpo humano a través de una picadura de mosquito, el Plasmodium se desliza a través de la piel humana antes de cruzar a los vasos sanguíneos humanos. Este tipo de movimiento se basa en la actina y la miosina, que son las mismas proteínas que permiten el movimiento muscular en los humanos y otros vertebrados. La miosina tiene una forma de "piernas" moleculares que "marchan" a lo largo de los filamentos de actina y así crean movimiento.
En Apicomplexa, la miosina interactúa con varias otras proteínas, que juntas forman un complejo llamado glideosoma. El mecanismo exacto por el cual funciona el glideosoma no se entiende bien, entre otras razones porque se desconoce la estructura molecular de la mayoría de las proteínas del glideosoma. Sin embargo, la comprensión de este mecanismo podría ayudar al desarrollo de medicamentos que impidan el ensamblaje del glideosoma y, por lo tanto, detengan la progresión de enfermedades como el paludismo y la toxoplasmosis.
Los científicos del EMBL de Hamburgo analizaron la estructura molecular de las cadenas ligeras esenciales (ELC), que son proteínas del glideosoma que se unen directamente a la miosina. Se sabe que son necesarias para el deslizamiento, pero su estructura y función exactas eran desconocidas hasta ahora. Los investigadores obtuvieron ahora estructuras moleculares de ELC unidas a la miosina A en Toxoplasma gondii y Plasmodium falciparum utilizando cristalografía de rayos X en las líneas de haz del EMBL en PETRA III y resonancia magnética nuclear (RMN). Su estudio muestra que las ELC funcionan como "zancos moleculares": al unirse a la miosina A, las ELC se vuelven rígidas, y comienzan a actuar como su brazo de palanca. Esta rigidez permite a la miosina dar pasos más largos, lo que probablemente acelera los movimientos de deslizamiento del parásito.
Los investigadores también investigaron el papel del calcio, un presunto regulador del deslizamiento, en la interacción entre las ELC y la miosina A. Sorprendentemente, descubrieron que el calcio no influye en la estructura de las ELC. Sin embargo, sí aumenta la estabilidad del complejo ELC-miosina A. Este resultado inesperado muestra que la arquitectura de los glideosomas todavía esconde muchas incógnitas.
El trabajo es el resultado de la colaboración interdisciplinaria entre biólogos estructurales y parasitólogos del EMBL y el Centro de Biología de Sistemas Estructurales CSSB en el campus de DESY en Hamburgo, así como científicos del Instituto Bernhard Nocht de Medicina Tropical en Hamburgo, la Universidad de Hamburgo y la Universidad Martin-Luther de Halle-Wittenberg.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.