La muerte celular o el crecimiento del cáncer: una cuestión de cohesión
La activación de CD95, un receptor que se encuentra en todas las células cancerosas, desencadena la muerte celular programada - o lo contrario, es decir, estimula el crecimiento de las células cancerosas. Los científicos del Centro Alemán de Investigación del cáncer (DKFZ) han demostrado que el impacto de la activación de CD95 depende de si hay células cancerosas aisladas o estructuras tridimensionales. Las células individuales están programadas para morir después de la activación del CD95. En contraste, la activación de CD95 estimula el crecimiento en grupos de células cancerosas, por ejemplo en tumores sólidos. Este hallazgo apunta a nuevas formas de transformar específicamente las señales estimulantes del crecimiento en señales de muerte celular para las células cancerosas.
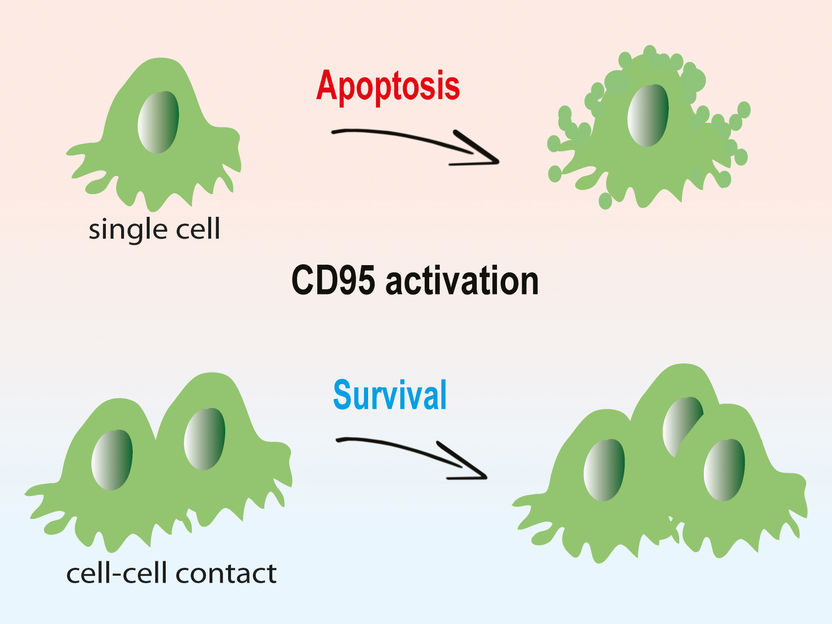
CD95: la activación en células cancerosas aisladas conduce a la apoptosis. En contraste, es un estímulo de crecimiento para las células cancerosas que crecen en estructuras tridimensionales.
G. Gülcüler/DKFZ
La proteína receptora CD95 está expuesta en la superficie de todas las células cancerosas, como las antenas pequeñas. La activación del receptor por el ligando CD95 (CD95L) desencadena la apoptosis en la célula cancerosa, o exactamente lo contrario: "Estudiamos varios tipos de tejido canceroso y encontramos que la activación de CD95 usualmente estimula el crecimiento del tumor bajo condiciones naturales", comentó Ana Martin-Villalba, quien ha estado llevando a cabo investigaciones en DKFZ sobre el papel de CD95 durante muchos años. Ella fue la primera en describir el efecto cancerígeno de CD95 en los glioblastomas (tumores cerebrales malignos).
Los investigadores están invirtiendo un esfuerzo considerable en examinar cómo la medicina podría aprovechar el otro lado de la CD95 y hacer que las células cancerosas mueran de una manera específica. Para ello, Martin-Villalba y su equipo intentaron comprender qué factores deciden si la activación de CD95 conduce a la muerte o al crecimiento celular.
El equipo de DKFZ colaboró con Motomu Tanaka de la Universidad de Heidelberg, desarrollando conjuntamente membranas celulares artificiales en las que podían insertar cualquier cantidad del ligando CD95. Usando este método, descubrieron que una distancia particular entre las moléculas individuales de los ligandos era necesaria para lograr la activación ideal de CD95 - y para inducir la muerte celular en células aisladas a partir de biopsias de cáncer de páncreas o glioblastomas cultivados en una placa de Petri.
Los investigadores entonces asumieron que habían encontrado la manera perfecta de causar la muerte de las células tumorales en el cuerpo y extendieron sus experimentos a los tumores cerebrales en ratones. Le dieron a los animales cuentas de látex con la densidad superficial ideal de los ligandos CD95. Sin embargo, en lugar de observar una reducción de la masa tumoral, como se esperaba, ocurrió lo contrario: se aceleró el crecimiento del tumor.
Para aclarar la aparente discrepancia entre el cultivo celular y los experimentos con animales, los investigadores experimentaron con "tumores", pequeños tumores que crecen en cultivo. La activación de CD95 a través de la membrana celular artificial estimuló el crecimiento de estos esferoides celulares, que se comportaron como tejido tumoral natural.
"El impacto de la activación de CD95 - muerte o crecimiento celular - parece depender principalmente de si hay células cancerosas aisladas, como las cultivadas en cultivo, o células en estructuras tridimensionales", explicó Gülce Gülcüler del equipo de Martin-Villalbas. Las células individuales están programadas para morir después de la activación del CD95. Sin embargo, en condiciones naturales, es decir, en una estructura tisular, la activación de CD95 estimula el crecimiento. En los experimentos de Gülcüler, incluso el contacto con una sola célula vecina fue suficiente para proteger a las células tumorales de la muerte celular inducida por CD95.
El resultado nos permitirá desarrollar nuevas estrategias para transformar las señales estimulantes del crecimiento de CD95 en señales de muerte celular para las células cancerosas". Esto podría ayudarnos a evitar que las células tumorales se vuelvan resistentes al tratamiento", agregó el director del estudio, Martin-Villalba.
Un estudio clínico de fase II realizado hace varios años ya demostró que, cuando se combina con radioterapia, el bloqueo de la señal CD95 podría conducir a mejores tasas de supervivencia en pacientes con glioblastomas avanzados. El estudio utilizó una sustancia en cuyo desarrollo Ana Martín Villalba desempeñó un papel clave. "Nuestros hallazgos actuales ofrecen una explicación por primera vez de por qué el bloqueo de la CD95 en realidad retrasa la muerte celular", explicó Martin-Villalba.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Gülce S. Gülcüler Balta, Cornelia Monzel, Susanne Kleber, Joel Beaudouin, Emre Balta, Thomas Kaindl, Si Chen, Liang Gao, Meinolf Thiemann, Christian R. Wirtz, Yvonne Samstag, Motomu Tanaka and Ana Martin-Villalba; "3D cellular architecture modulates tyrosine kinase activity thereby switching CD95 mediated apoptosis to survival"; Cell Reports; 2019