Descubren nueva forma en que la insulina interactúa con su receptor
Desde el descubrimiento de la insulina hace casi 100 años, los científicos han explorado cómo interactúa con su receptor con el objetivo de mejorar la capacidad de las insulinas terapéuticas para imitar la forma en que la insulina funciona en el cuerpo. En un nuevo estudio, los investigadores han resuelto una pieza crítica del rompecabezas mostrando cómo interactúa la insulina con su receptor en un segundo sitio de unión.
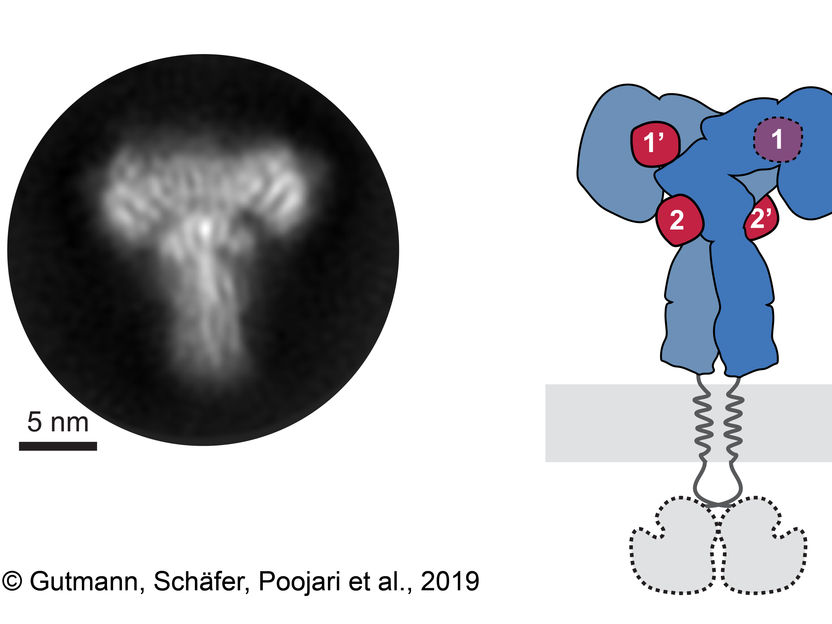
Un promedio de la clase 2D del ectodominio del receptor de insulina (izquierda) y el esquema correspondiente del receptor (derecha). El ectodominio del receptor de insulina y las 4 insulinas son de color azul y rojo.
© Gutmann, Schäfer, Poojari et al. 2019
El equipo de científicos del Instituto Paul Langerhans de Dresde (un satélite del Helmholtz Zentrum München y socio del Centro Alemán para la Investigación de la Diabetes) y de la Facultad de Medicina Carl Gustav Carus de la Universidad Politécnica de Dresde en Alemania, junto con colegas del Instituto Max Planck de Bioquímica de Múnich, Alemania, de la Universidad McGill de Canadá y de la Universidad de Helsinki en Finlandia publicarán sus resultados en el Journal of Cell Biology (JCB).
Estudios anteriores han detallado el papel central de la insulina como regulador del azúcar en sangre y han demostrado su implicación en la diabetes y otras afecciones crónicas, incluyendo la neurodegeneración y el cáncer. Las acciones biológicas de la insulina están mediadas por su receptor, el receptor de insulina, que se localiza en la superficie de la célula.
"Cuando se administró insulina a los pacientes por primera vez en la década de 1920, fue un verdadero avance en el tratamiento de la diabetes. Sin embargo, todavía es difícil generar insulinas que recapitulen todo el espectro de la acción de la insulina endógena", explica el Dr. Ünal Coskun, líder del grupo en el Instituto de Investigación de los Islotes Pancreáticos (IPI) y el Instituto Paul Langerhans de Dresde (PLID), socio del Centro Alemán para la Investigación de la Diabetes (DZD). "La razón principal de esto es que todavía no entendemos lo suficiente sobre cómo la insulina se une a su receptor y cómo se transmite esta señal dentro de la célula".
La insulina fue propuesta por primera vez para unirse a dos sitios diferentes en su receptor hace 40 años. Aunque se entiende mucho acerca de las interacciones que ocurren en el primero de estos sitios, se sabe muy poco acerca de lo que sucede en el segundo sitio. Comprender las diferentes maneras en que la insulina puede interactuar con su receptor permitirá a los investigadores diseñar mejores tratamientos para los trastornos relacionados con la insulina.
En el nuevo estudio, los investigadores muestran cómo la insulina se une al sitio 2. Utilizando una técnica poderosa conocida como microscopía crioelectrónica, los investigadores obtienen una imagen 3D detallada del ectodominio del receptor de insulina unido a la insulina.
"La clave fue examinar la parte externa, o ectodominio, del receptor de insulina después de saturarlo con altas concentraciones de insulina", explica la Dra. Theresia Gutmann, primera autora del estudio del Instituto Paul Langerhans y del Centro Alemán para la Investigación de la Diabetes. El Dr. Ingmar Schäfer, del Departamento de Biología Celular Estructural del Instituto Max-Planck de Bioquímica (MPIB), añade: "Registramos más de 8.000 imágenes microscópicas electrónicas y analizamos más de 300.000 partículas de un solo receptor, a partir de las cuales pudimos generar imágenes en 2D del complejo en forma de "T" para reconstruir una imagen en 3D".
Este enfoque permitió a los investigadores observar directamente la unión de la insulina al sitio 2 por primera vez y mostrar cómo el receptor de insulina cambia su conformación para formar una estructura en forma de T. El receptor consta de dos partes idénticas, cada una de las cuales contiene dos sitios de unión a la insulina, por lo que hasta 4 moléculas de insulina fueron unidas por un solo receptor.
Paralelamente, los científicos utilizaron modelos computacionales y enfoques de simulación para comprender estas interacciones a escala atómica. "Las técnicas computacionales como éstas son cada vez más importantes para analizar procesos dinámicos complicados en las células vivas, con la ventaja añadida de permitir que las pruebas de detección de drogas se realicen en silico", dice el profesor Ilpo Vattulainen, del Departamento de Física de la Universidad de Helsinki.
Los estudios previos que analizaban la estructura del receptor de insulina eran difíciles de conciliar con los datos bioquímicos y genéticos sobre cómo interactúa la insulina con su receptor. Los científicos esperan que estos nuevos detalles sobre las interacciones insulino-receptor amplíen en última instancia los modelos actuales de unión de la insulina a su receptor y allanen el camino hacia nuevos enfoques para el diseño de fármacos basados en estructuras.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.